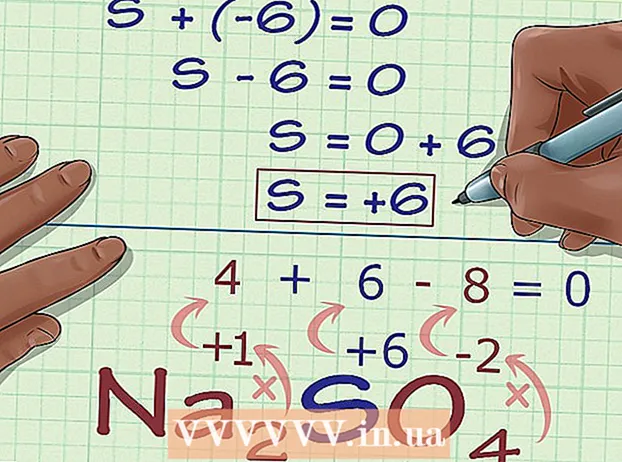
Ábhar
- Chun céim
- Cuid 1 de 2: Uimhreacha ocsaídiúcháin a shannadh bunaithe ar rialacha ceimiceacha
- Cuid 2 de 2: Uimhreacha a shannadh d’adamh gan na rialacha maidir le huimhreacha ocsaídiúcháin
- Leideanna
- Riachtanais
Sa cheimic, ciallaíonn na téarmaí "ocsaídiú" agus "laghdú" na frithghníomhartha sin ina gcaillfidh nó ina bhfaigheann adamh (nó grúpa adamh) leictreoin, faoi seach. Is éard atá in uimhreacha ocsaídiúcháin ná uimhreacha a shanntar d’adamh (nó grúpaí adamh) chun cabhrú le ceimiceoirí rialú a dhéanamh ar an líon leictreon atá ar fáil le díláithriú agus cibé acu a thugtar imoibreáin ocsaídithe nó laghdaithe le linn imoibriúcháin. Is féidir leis an bpróiseas chun uimhreacha ocsaídiúcháin a shannadh d’adamh raon a bheith ó shimplí go casta, ag brath ar mhuirear na n-adamh agus comhdhéanamh ceimiceach na móilíní ar cuid díobh iad. Chun rudaí a dhéanamh níos casta, is féidir go mbeidh uimhreacha ocsaídiúcháin iolracha ag roinnt adamh. Ar ámharaí an tsaoil, tá sannadh uimhreacha ocsaídiúcháin faoi rialú ag rialacha atá sainmhínithe go soiléir agus éasca le leanúint, ach beidh sé níos éasca tuiscint bhunúsach a fháil ar cheimic agus ar ailgéabar trí na rialacha seo a úsáid.
Chun céim
Cuid 1 de 2: Uimhreacha ocsaídiúcháin a shannadh bunaithe ar rialacha ceimiceacha
 Faigh amach an bhfuil an tsubstaint atá i gceist eiliminteach. Bíonn uimhir ocsaídiúcháin de 0. i gcónaí ag adamh neamhcheangailte, tá sé seo fíor i gcás an dá adamh arb éard atá iontu adamh aonair agus adamh a bhfuil a bhfoirm eiliminteach diatómach nó polaatómach.
Faigh amach an bhfuil an tsubstaint atá i gceist eiliminteach. Bíonn uimhir ocsaídiúcháin de 0. i gcónaí ag adamh neamhcheangailte, tá sé seo fíor i gcás an dá adamh arb éard atá iontu adamh aonair agus adamh a bhfuil a bhfoirm eiliminteach diatómach nó polaatómach. - Mar shampla, Al(í) agus Cl2 tá an uimhir ocsaídiúcháin 0 ag an mbeirt acu toisc nach adamh cumaisc iad.
- Tabhair faoi deara go bhfuil sulfair ina fhoirm eiliminteach, S.8 (octasulfur), cé go bhfuil sé neamhrialta, tá uimhir ocsaídiúcháin 0 aige freisin.
 Faigh amach más ian an tsubstaint atá i gceist. Tá uimhreacha ocsaídiúcháin ag ian atá cothrom lena muirear. Tá sé seo fíor maidir le hiain neamhcheangailte chomh maith le hiain atá mar chuid d’iain ilchodach.
Faigh amach más ian an tsubstaint atá i gceist. Tá uimhreacha ocsaídiúcháin ag ian atá cothrom lena muirear. Tá sé seo fíor maidir le hiain neamhcheangailte chomh maith le hiain atá mar chuid d’iain ilchodach. - Mar shampla, tá uimhir ocsaídiúcháin -1 ag an ian Cl.
- An ian Cl fós uimhir ocsaídiúcháin -1 nuair atá sé mar chuid den chomhdhúil NaCl. Ós rud é go bhfuil muirear +1 ag an ian Na, de réir sainmhínithe, tá a fhios againn go bhfuil muirear -1 ag an ian Cl, ionas go mbeidh an uimhir ocsaídiúcháin fós -1.
 I gcás iain miotail, is maith a mheabhrú go bhfuil iliomad uimhreacha ocsaídiúcháin indéanta. Is féidir le níos mó ná tuirlingt amháin a bheith ag go leor miotail. Mar shampla, is féidir leis an iarann miotail (Fe) a bheith ina ian le lucht +2 nó +3. is féidir muirear na n-ian miotail (agus dá bhrí sin a n-uimhreacha ocsaídiúcháin) a chinneadh i ndáil le lucht na n-adamh eile a bhfuil siad ina gcomhdhéanamh, nó, nuair a scríobhtar iad mar théacs, leis an nodaireacht in uimhreacha Rómhánacha (mar atá i an abairt: "Tá muirear +3 ag an ian iarainn (III).").
I gcás iain miotail, is maith a mheabhrú go bhfuil iliomad uimhreacha ocsaídiúcháin indéanta. Is féidir le níos mó ná tuirlingt amháin a bheith ag go leor miotail. Mar shampla, is féidir leis an iarann miotail (Fe) a bheith ina ian le lucht +2 nó +3. is féidir muirear na n-ian miotail (agus dá bhrí sin a n-uimhreacha ocsaídiúcháin) a chinneadh i ndáil le lucht na n-adamh eile a bhfuil siad ina gcomhdhéanamh, nó, nuair a scríobhtar iad mar théacs, leis an nodaireacht in uimhreacha Rómhánacha (mar atá i an abairt: "Tá muirear +3 ag an ian iarainn (III)."). - Mar shampla, déanaimis féachaint níos dlúithe ar chomhdhúil ina bhfuil ian alúmanaim. An cumaisc AlCl3 tá muirear 0. aige toisc go bhfuil a fhios againn go bhfuil luchtú -1 ag ian Cl agus go bhfuil 3 ian Cl sa chomhdhúil, ní mór go mbeadh muirear +3 ag an Al-ian, ionas go mbeidh muirear na n-ian go léir le chéile Is 0. Mar sin, is é +3 uimhir ocsaídiúcháin Al.
 Tabhair uimhir ocsaídiúcháin -2 do ocsaigin (cé is moite de). I beagnach i ngach cás, tá uimhir ocsaídiúcháin -2 ag adamh ocsaigine. Tá roinnt eisceachtaí ón riail seo:
Tabhair uimhir ocsaídiúcháin -2 do ocsaigin (cé is moite de). I beagnach i ngach cás, tá uimhir ocsaídiúcháin -2 ag adamh ocsaigine. Tá roinnt eisceachtaí ón riail seo: - Nuair a bhíonn ocsaigin sa stát eiliminteach (O.2), ansin tá an uimhir ocsaídiúcháin cothrom le 0, mar atá i gcás gach adamh bunrang.
- Nuair a bhíonn ocsaigin mar chuid de sárocsaíd, ansin is é -1 an uimhir ocsaídiúcháin. Is aicme comhdhúile iad sárocsaídí a bhfuil banna ocsaigine-ocsaigine acu (nó an anion sárocsaíd O.2). Mar shampla, sa mhóilín H.2O.2 (sárocsaíd hidrigine), tá uimhir ocsaídiúcháin (agus luchtú) de -1.Also ag ocsaigin, nuair a bhíonn ocsaigin mar chuid de sárocsaíd, is é -0.5 an uimhir ocsaídiúcháin.
- Nuair a bhíonn ocsaigin ceangailte le fluairín, is é +2 an uimhir ocsaídiúcháin. Féach riail na bhflóra thíos chun tuilleadh faisnéise a fháil. In (O.2F.2) seo +1.
 Tabhair uimhir ocsaídiúcháin +1 do hidrigin (cé is moite de). Cosúil le hocsaigin, braitheann líon ocsaídiúcháin hidrigine ar chásanna eisceachtúla. De ghnáth, bíonn uimhir ocsaídiúcháin +1 ag hidrigin (ach amháin i bhfoirm eiliminteach, H.2). Ach i gcás comhdhúil speisialta ar a dtugtar hibridí, tá uimhir ocsaídiúcháin -1 ag hidrigin.
Tabhair uimhir ocsaídiúcháin +1 do hidrigin (cé is moite de). Cosúil le hocsaigin, braitheann líon ocsaídiúcháin hidrigine ar chásanna eisceachtúla. De ghnáth, bíonn uimhir ocsaídiúcháin +1 ag hidrigin (ach amháin i bhfoirm eiliminteach, H.2). Ach i gcás comhdhúil speisialta ar a dtugtar hibridí, tá uimhir ocsaídiúcháin -1 ag hidrigin. - Mar shampla, ó H.2Ó, tá a fhios againn go bhfuil uimhir ocsaídiúcháin +1 ag hidrigin toisc go bhfuil muirear -2 ag ocsaigin agus teastaíonn 2 +1 muirear uainn chun comhdhúil a dhéanamh le muirear iomlán nialas. Ach leis an tsubstaint hidríd sóidiam, NaH, tá uimhir ocsaídiúcháin -1 ag hidrigin toisc go bhfuil muirear +1 ag an ian Na agus, chun muirear iomlán an chomhdhúil 0 a dhéanamh, tá muirear ag hidrigin (agus dá bhrí sin uimhir ocsaídiúcháin) de -1.
 Fluairín i gcónaí uimhir ocsaídiúcháin -1. Mar a léirítear thuas, féadann líon ocsaídiúcháin eilimintí áirithe athrú mar gheall ar fhachtóirí éagsúla (iain miotail, adamh ocsaigine i sárocsaídí, srl.). Ar an láimh eile, tá uimhir ocsaídiúcháin -1 ag fluairín, agus ní athraíonn sé sin riamh. Tarlaíonn sé seo toisc gurb í fluairín an eilimint is leictrea-dhiúltach, nó i bhfocail eile, is í an eilimint is lú toilteanach leictreoin a thabhairt suas agus is dóichí a ghlacfaidh leictreoin ó adamh eile. Dá bhrí sin, ní thiocfaidh aon athrú ar an uimhir ocsaídiúcháin.
Fluairín i gcónaí uimhir ocsaídiúcháin -1. Mar a léirítear thuas, féadann líon ocsaídiúcháin eilimintí áirithe athrú mar gheall ar fhachtóirí éagsúla (iain miotail, adamh ocsaigine i sárocsaídí, srl.). Ar an láimh eile, tá uimhir ocsaídiúcháin -1 ag fluairín, agus ní athraíonn sé sin riamh. Tarlaíonn sé seo toisc gurb í fluairín an eilimint is leictrea-dhiúltach, nó i bhfocail eile, is í an eilimint is lú toilteanach leictreoin a thabhairt suas agus is dóichí a ghlacfaidh leictreoin ó adamh eile. Dá bhrí sin, ní thiocfaidh aon athrú ar an uimhir ocsaídiúcháin.  Tá na huimhreacha ocsaídiúcháin i gcomhdhúil cothrom le lucht an chomhdhúil. Tá líon ocsaídiúcháin na n-adamh go léir i gcomhdhúil cothrom le lucht an chomhdhúil sin. Mar shampla, mura bhfuil aon mhuirear ar chomhdhúil, ansin is é suim na n-uimhreacha ocsaídiúcháin go léir ná nialas; más ian polaatómach é an comhdhúil le muirear -1, ansin caithfidh na huimhreacha ocsaídiúcháin breise a bheith -1, srl.
Tá na huimhreacha ocsaídiúcháin i gcomhdhúil cothrom le lucht an chomhdhúil. Tá líon ocsaídiúcháin na n-adamh go léir i gcomhdhúil cothrom le lucht an chomhdhúil sin. Mar shampla, mura bhfuil aon mhuirear ar chomhdhúil, ansin is é suim na n-uimhreacha ocsaídiúcháin go léir ná nialas; más ian polaatómach é an comhdhúil le muirear -1, ansin caithfidh na huimhreacha ocsaídiúcháin breise a bheith -1, srl. - Is bealach maith é seo chun do fhreagra a sheiceáil - mura ionann uimhreacha ocsaídiúcháin comhdhúil le muirear an chomhdhúil sin, ansin tá a fhios agat go ndearna tú botún.
Cuid 2 de 2: Uimhreacha a shannadh d’adamh gan na rialacha maidir le huimhreacha ocsaídiúcháin
 Faigh adamh gan rialacha maidir le huimhreacha ocsaídiúcháin. Ní leanann roinnt adamh na rialacha chun uimhreacha ocsaídiúcháin a fháil. Mura gcomhlíonann adamh na rialacha thuas agus mura bhfuil tú cinnte cad é a mhuirear (mar shampla, más cuid de chomhdhúil níos mó é ionas nach mbeidh an lucht aonair ar eolas), is féidir leat uimhir ocsaídiúcháin an adaimh sin a fháil trí díothú. Ar dtús socraíonn tú cad é ocsaídiú gach adaimh eile sa chomhdhúil. Ansin réitíonn tú an tsuim don anaithnid sa chothromóid, bunaithe ar mhuirear iomlán an chomhdhúil.
Faigh adamh gan rialacha maidir le huimhreacha ocsaídiúcháin. Ní leanann roinnt adamh na rialacha chun uimhreacha ocsaídiúcháin a fháil. Mura gcomhlíonann adamh na rialacha thuas agus mura bhfuil tú cinnte cad é a mhuirear (mar shampla, más cuid de chomhdhúil níos mó é ionas nach mbeidh an lucht aonair ar eolas), is féidir leat uimhir ocsaídiúcháin an adaimh sin a fháil trí díothú. Ar dtús socraíonn tú cad é ocsaídiú gach adaimh eile sa chomhdhúil. Ansin réitíonn tú an tsuim don anaithnid sa chothromóid, bunaithe ar mhuirear iomlán an chomhdhúil. - Mar shampla, sa chomhdhúil Na2SO4, ní fios an muirear sulfair (S) - níl sé ina fhoirm eiliminteach, mar sin níl sé 0, ach sin uile atá ar eolas againn. Is iarrthóir maith é seo chun an modh seo a chur i bhfeidhm chun an uimhir ocsaídiúcháin a chinneadh go hailgéabrach.
 Faigh amach líon ocsaídiúcháin aitheanta na n-eilimintí eile sa chomhdhúil. Ag baint úsáide as na rialacha maidir le sannadh uimhreacha ocsaídiúcháin, socraímid na huimhreacha ocsaídiúcháin atá ag na hadaimh eile sa chomhdhúil. Bí ar an eolas faoi eisceachtaí mar O, H, srl.
Faigh amach líon ocsaídiúcháin aitheanta na n-eilimintí eile sa chomhdhúil. Ag baint úsáide as na rialacha maidir le sannadh uimhreacha ocsaídiúcháin, socraímid na huimhreacha ocsaídiúcháin atá ag na hadaimh eile sa chomhdhúil. Bí ar an eolas faoi eisceachtaí mar O, H, srl. - I Na2SO4, tá a fhios againn, bunaithe ar ár sraith rialacha, go bhfuil muirear (agus uimhir ocsaídiúcháin) de +1 ag an ian Na agus go bhfuil uimhreacha ocsaídiúcháin -2 ag na hadaimh ocsaigine.
 Déan líon gach adamh a iolrú faoin uimhir ocsaídiúcháin. Anois go bhfuil líon ocsaídiúcháin na n-adamh go léir ar eolas againn seachas anaithnid, caithfimid a mheas go bhféadfadh cuid de na hadaimh seo tarlú níos mó ná uair amháin. Déan gach comhéifeacht (scríofa i síntiús tar éis siombail an adaimh sa chomhdhúil) a iolrú faoin uimhir ocsaídiúcháin.
Déan líon gach adamh a iolrú faoin uimhir ocsaídiúcháin. Anois go bhfuil líon ocsaídiúcháin na n-adamh go léir ar eolas againn seachas anaithnid, caithfimid a mheas go bhféadfadh cuid de na hadaimh seo tarlú níos mó ná uair amháin. Déan gach comhéifeacht (scríofa i síntiús tar éis siombail an adaimh sa chomhdhúil) a iolrú faoin uimhir ocsaídiúcháin. - Maidir le Na2SO4, tá a fhios againn go bhfuil 2 adamh Na agus 4 adamh O. Anois déanaimid an ríomh seo a leanas, 2 × +1, chun uimhir ocsaídiúcháin Na, 2 a fháil, agus iolraímid 4 × -2, uimhir ocsaídiúcháin O, -8.
 Cuir suas na torthaí. Nuair a chuirtear torthaí na n-iolraithe seo le huimhir ocsaídiúcháin an chomhdhúil, sin ag cur uimhir ocsaídiúcháin an adaimh anaithnid san áireamh.
Cuir suas na torthaí. Nuair a chuirtear torthaí na n-iolraithe seo le huimhir ocsaídiúcháin an chomhdhúil, sin ag cur uimhir ocsaídiúcháin an adaimh anaithnid san áireamh. - In ár sampla le Na2SO4, cuirimid 2 go -8 chun -6 a fháil.
 Ríomh an uimhir ocsaídiúcháin anaithnid bunaithe ar mhuirear an chomhdhúil. Tá na sonraí go léir agat anois chun an uimhir ocsaídiúcháin anaithnid a fháil ag baint úsáide as roinnt ailgéabar simplí. Úsáidfimid cothromóid agus an freagra ón gcéim roimhe seo, móide muirear an chomhdhúil. I bhfocail eile: (Suim na n-uimhreacha ocsaídiúcháin anaithnid) + (an uimhir ocsaídiúcháin anaithnid a theastaíonn uait a fháil amach) = (luchtú an chomhdhúil).
Ríomh an uimhir ocsaídiúcháin anaithnid bunaithe ar mhuirear an chomhdhúil. Tá na sonraí go léir agat anois chun an uimhir ocsaídiúcháin anaithnid a fháil ag baint úsáide as roinnt ailgéabar simplí. Úsáidfimid cothromóid agus an freagra ón gcéim roimhe seo, móide muirear an chomhdhúil. I bhfocail eile: (Suim na n-uimhreacha ocsaídiúcháin anaithnid) + (an uimhir ocsaídiúcháin anaithnid a theastaíonn uait a fháil amach) = (luchtú an chomhdhúil).- I sampla Na2SO4, réitímid é seo mar a leanas:
- (Suim na n-uimhreacha ocsaídiúcháin is eol) + (uimhir ocsaídiúcháin anaithnid ba mhaith leat a réiteach) = (luchtú an chomhdhúil)
- -6 + S = 0
- S = 0 + 6
- Tá uimhir ocsaídiúcháin ag S = 6. S. 6 in Na2SO4.
- I sampla Na2SO4, réitímid é seo mar a leanas:
Leideanna
- Bíonn uimhir ocsaídiúcháin de 0. i gcónaí ag adaimh ina bhfoirm bhunúsach. Tá uimhir ocsaídiúcháin ag ian atá comhdhéanta de 1 adamh atá cothrom leis an lucht. Tá uimhir ocsaídiúcháin +1 ag miotail Ghrúpa 1A mar hidrigin, litiam agus sóidiam; Tá uimhir ocsaídiúcháin +2 ag miotail Ghrúpa 2A, mar mhaignéisiam agus cailciam. Is féidir le 2 uimhir ocsaídiúcháin dhifriúla a bheith ag hidrigin agus ocsaigin, ag brath ar a mbanna.
- I gcomhdhúil ba chóir go mbeadh suim na n-uimhreacha ocsaídiúcháin uile cothrom le 0. Má tá ian ann le 2 adamh, ansin ba chóir go mbeadh suim na n-uimhreacha ocsaídiúcháin cothrom le lucht na hiain.
- Tá sé an-úsáideach fios a bheith agat conas an tábla peiriadach a léamh agus cá bhfaighidh tú na miotail agus na neamh-mhiotail.
Riachtanais
- Tábla tréimhsiúil na n-eilimintí
- Nasc idirlín
- Leabhar ceimice
- Páipéar, peann nó peann luaidhe
- Áireamhán