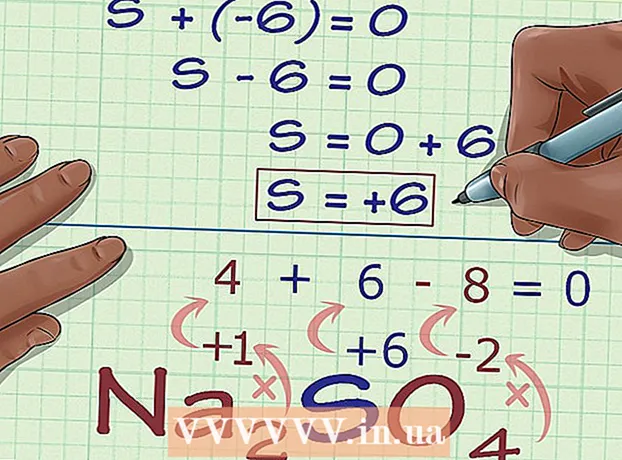
Ábhar
- Céimeanna
- Cuid 1 de 2: An stát ocsaídiúcháin a chinneadh de réir dhlíthe na ceimice
- Cuid 2 de 2: An staid ocsaídiúcháin a chinneadh gan dlíthe na ceimice a úsáid
- Leideanna
- Céard atá ag teastáil uait
Sa cheimic, ciallaíonn na téarmaí "ocsaídiú" agus "laghdú" frithghníomhartha ina gcaillfidh adamh nó grúpa adamh nó, faoi seach, leictreoin a fháil. Is luach uimhriúil é an stát ocsaídiúcháin a shanntar d’adamh amháin nó níos mó arb iad is sainairíonna líon na leictreon athdháilte agus a thaispeánann conas a dháiltear na leictreoin seo idir adamh le linn imoibriúcháin. Is nós imeachta simplí agus casta go leor é an luach seo a chinneadh, ag brath ar na hadaimh agus na móilíní atá iontu. Thairis sin, is féidir go bhfuil roinnt stát ocsaídiúcháin ag adamh roinnt eilimintí. Ar ámharaí an tsaoil, tá rialacha simplí gan athbhrí ann chun an stát ocsaídiúcháin a chinneadh, ar leor é le húsáid mhuiníneach as buneilimintí na ceimice agus an ailgéabair.
Céimeanna
Cuid 1 de 2: An stát ocsaídiúcháin a chinneadh de réir dhlíthe na ceimice
 1 Faigh amach an bhfuil an tsubstaint atá i gceist eiliminteach. Is é náid staid ocsaídiúcháin na n-adamh lasmuigh de chomhdhúil cheimiceach. Tá an riail seo fíor i gcás substaintí a fhoirmítear ó adamh saor in aisce ar leithligh, agus dóibh siúd atá comhdhéanta de dhá mhóilín, nó móilíní polaatómacha in eilimint amháin.
1 Faigh amach an bhfuil an tsubstaint atá i gceist eiliminteach. Is é náid staid ocsaídiúcháin na n-adamh lasmuigh de chomhdhúil cheimiceach. Tá an riail seo fíor i gcás substaintí a fhoirmítear ó adamh saor in aisce ar leithligh, agus dóibh siúd atá comhdhéanta de dhá mhóilín, nó móilíní polaatómacha in eilimint amháin. - Mar shampla, Al(í) agus Cl2 tá staid ocsaídiúcháin 0 acu, ós rud é go bhfuil an dá cheann i stát eiliminteach neamhcheangailte go ceimiceach.
- Tabhair faoi deara go bhfuil an fhoirm allotrópach de shulfar S.8, in ainneoin a struchtúir aitíopúla, tá stát ocsaídiúcháin nialas tréithrithe freisin.
 2 Faigh amach an bhfuil ian sa tsubstaint atá i gceist. Tá staid ocsaídiúcháin na n-ian cothrom lena muirear. Tá sé seo fíor i gcás ian saor agus dóibh siúd atá mar chuid de chomhdhúile ceimiceacha.
2 Faigh amach an bhfuil ian sa tsubstaint atá i gceist. Tá staid ocsaídiúcháin na n-ian cothrom lena muirear. Tá sé seo fíor i gcás ian saor agus dóibh siúd atá mar chuid de chomhdhúile ceimiceacha. - Mar shampla, is é -1 staid an ocsaídiúcháin san ian Cl.
- Is é -1 staid an ocsaídiúcháin san ian Cl sa chomhdhúil cheimiceach NaCl. Ó tharla go bhfuil muirear +1 ag an ian Na, de réir sainmhínithe, tagaimid ar an gconclúid gurb é -1 luchtaithe an ian Cl, agus dá bhrí sin is é a staid ocsaídiúcháin -1.
 3 Tabhair faoi deara le do thoil go bhféadfadh go leor stát ocsaídiúcháin a bheith ag iain miotail. Is féidir le hadaimh a lán eilimintí miotalacha ianú go méideanna éagsúla. Mar shampla, is é +2 nó +3 muirear ian miotail mar iarann (Fe). Is féidir muirear ian miotail (agus a staid ocsaídiúcháin) a chinneadh trí mhuirir iain eilimintí eile a bhfuil an miotal seo mar chuid de chomhdhúil cheimiceach leo; sa téacs, cuirtear uimhreacha Rómhánacha in iúl don mhuirear seo: mar shampla, tá staid ocsaídiúcháin +3 ag iarann (III).
3 Tabhair faoi deara le do thoil go bhféadfadh go leor stát ocsaídiúcháin a bheith ag iain miotail. Is féidir le hadaimh a lán eilimintí miotalacha ianú go méideanna éagsúla. Mar shampla, is é +2 nó +3 muirear ian miotail mar iarann (Fe). Is féidir muirear ian miotail (agus a staid ocsaídiúcháin) a chinneadh trí mhuirir iain eilimintí eile a bhfuil an miotal seo mar chuid de chomhdhúil cheimiceach leo; sa téacs, cuirtear uimhreacha Rómhánacha in iúl don mhuirear seo: mar shampla, tá staid ocsaídiúcháin +3 ag iarann (III). - Mar shampla, smaoinigh ar chomhdhúil ina bhfuil ian alúmanaim. Muirear iomlán comhdhúil AlCl3 is nialas.Ós rud é go bhfuil a fhios againn go bhfuil muirear -1 ag ian Cl, agus go bhfuil 3 ian den sórt sin sa chomhdhúil, maidir le neodracht ghinearálta na substainte atá i gceist, ní mór go mbeadh muirear + 3 ag an ian Al. Mar sin, sa chás seo, is é +3 staid ocsaídiúcháin alúmanaim.
 4 Is é -2 staid ocsaídiúcháin ocsaigine (le roinnt eisceachtaí). I mbeagnach gach cás, tá staid ocsaídiúcháin de -2 ag adamh ocsaigine. Tá roinnt eisceachtaí ann maidir leis an riail seo:
4 Is é -2 staid ocsaídiúcháin ocsaigine (le roinnt eisceachtaí). I mbeagnach gach cás, tá staid ocsaídiúcháin de -2 ag adamh ocsaigine. Tá roinnt eisceachtaí ann maidir leis an riail seo: - Má tá ocsaigin sa stát eiliminteach (O.2), is é a staid ocsaídiúcháin ná 0, mar atá i gcás substaintí tosaigh eile.
- Má tá ocsaigin mar chuid de sárocsaíd, is é a staid ocsaídiúcháin -1. Is grúpa comhdhúile iad sárocsaídí ina bhfuil banna simplí ocsaigine-ocsaigine (i.e. an t-anion sárocsaíde O.2). Mar shampla, i gcomhdhéanamh an H.2O.2 tá stát luchtaithe agus ocsaídiúcháin -1 ag sárocsaíd hidrigine.
- Nuair a dhéantar é a chomhcheangal le fluairín, tá staid ocsaídiúcháin +2 ag ocsaigin, léigh an riail maidir le fluairín thíos.
 5 Tá staid ocsaídiúcháin de +1 ag hidrigin, ach cúpla eisceacht. Mar is amhlaidh le hocsaigin, tá eisceachtaí ann freisin. De ghnáth, is é +1 staid ocsaídiúcháin hidrigine (mura bhfuil sé sa stát eiliminteach H.2). Mar sin féin, i gcomhdhúile ar a dtugtar hidrídí, is é -1 staid an ocsaídiúcháin hidrigine.
5 Tá staid ocsaídiúcháin de +1 ag hidrigin, ach cúpla eisceacht. Mar is amhlaidh le hocsaigin, tá eisceachtaí ann freisin. De ghnáth, is é +1 staid ocsaídiúcháin hidrigine (mura bhfuil sé sa stát eiliminteach H.2). Mar sin féin, i gcomhdhúile ar a dtugtar hidrídí, is é -1 staid an ocsaídiúcháin hidrigine. - Mar shampla, in H.2O Is é +1 staid ocsaídiúcháin hidrigine toisc go bhfuil muirear -2 ag an adamh ocsaigine, agus teastaíonn dhá lucht + +1 don neodracht fhoriomlán. Mar sin féin, i gcomhdhéanamh hidríd sóidiam, tá staid ocsaídiúcháin hidrigine -1 cheana féin, ós rud é go bhfuil muirear +1 ag an ian Na, agus maidir leis an leictridhiúltacht ghinearálta, ba cheart go mbeadh muirear an adaimh hidrigine (agus dá bhrí sin a staid ocsaídiúcháin) bí -1.
 6 Fluairín i gcónaí tá staid ocsaídiúcháin de -1 aige. Mar a tugadh faoi deara cheana féin, féadann staid ocsaídiúcháin roinnt eilimintí (iain miotail, adamh ocsaigine i sárocsaídí, agus mar sin de) a bheith éagsúil ag brath ar roinnt fachtóirí. Is é staid ocsaídiúcháin fluairín, áfach, i gcónaí -1. Tarlaíonn sé seo toisc go bhfuil an leictridhiúltacht is mó ag an eilimint seo - is é sin le rá, is iad adamh fluairín is lú a bhíonn sásta páirt a ghlacadh lena leictreoin féin agus leictreoin choigríche a mhealladh go gníomhach. Dá bhrí sin, tá a muirear gan athrú.
6 Fluairín i gcónaí tá staid ocsaídiúcháin de -1 aige. Mar a tugadh faoi deara cheana féin, féadann staid ocsaídiúcháin roinnt eilimintí (iain miotail, adamh ocsaigine i sárocsaídí, agus mar sin de) a bheith éagsúil ag brath ar roinnt fachtóirí. Is é staid ocsaídiúcháin fluairín, áfach, i gcónaí -1. Tarlaíonn sé seo toisc go bhfuil an leictridhiúltacht is mó ag an eilimint seo - is é sin le rá, is iad adamh fluairín is lú a bhíonn sásta páirt a ghlacadh lena leictreoin féin agus leictreoin choigríche a mhealladh go gníomhach. Dá bhrí sin, tá a muirear gan athrú.  7 Tá suim na stát ocsaídiúcháin i gcomhdhúil cothrom lena muirear. Ba chóir go gcuirfeadh stáit ocsaídiúcháin na n-adamh go léir atá ina gcomhdhúil cheimiceach le muirear an chomhdhúil seo. Mar shampla, má tá comhdhúil neodrach, ba cheart go mbeadh suim stáit ocsaídiúcháin a adamh go léir nialasach; más ian polaatómach é an comhdhúil le muirear -1, is é suim na stát ocsaídiúcháin ná -1, agus mar sin de.
7 Tá suim na stát ocsaídiúcháin i gcomhdhúil cothrom lena muirear. Ba chóir go gcuirfeadh stáit ocsaídiúcháin na n-adamh go léir atá ina gcomhdhúil cheimiceach le muirear an chomhdhúil seo. Mar shampla, má tá comhdhúil neodrach, ba cheart go mbeadh suim stáit ocsaídiúcháin a adamh go léir nialasach; más ian polaatómach é an comhdhúil le muirear -1, is é suim na stát ocsaídiúcháin ná -1, agus mar sin de. - Is modh tástála maith é seo - mura ionann suim na stát ocsaídiúcháin agus muirear iomlán an chomhdhúil, ansin tá tú mícheart áit éigin.
Cuid 2 de 2: An staid ocsaídiúcháin a chinneadh gan dlíthe na ceimice a úsáid
 1 Faigh adaimh nach bhfuil rialacha dochta acu maidir lena staid ocsaídiúcháin. I gcás roinnt eilimintí, níl aon rialacha bunaithe go daingean chun an stát ocsaídiúcháin a aimsiú. Mura n-oireann adamh le haon cheann de na rialacha a liostaítear thuas, agus mura bhfuil a mhuirear ar eolas agat (mar shampla, tá an t-adamh mar chuid de choimpléasc, agus ní shonraítear a mhuirear), is féidir leat staid ocsaídiúcháin adamh den sórt sin a chinneadh trí eisiamh. Ar dtús, faigh muirear gach adamh eile sa chomhdhúil, agus ansin, ó mhuirear iomlán aitheanta an chomhdhúil, ríomh staid ocsaídiúcháin an adaimh seo.
1 Faigh adaimh nach bhfuil rialacha dochta acu maidir lena staid ocsaídiúcháin. I gcás roinnt eilimintí, níl aon rialacha bunaithe go daingean chun an stát ocsaídiúcháin a aimsiú. Mura n-oireann adamh le haon cheann de na rialacha a liostaítear thuas, agus mura bhfuil a mhuirear ar eolas agat (mar shampla, tá an t-adamh mar chuid de choimpléasc, agus ní shonraítear a mhuirear), is féidir leat staid ocsaídiúcháin adamh den sórt sin a chinneadh trí eisiamh. Ar dtús, faigh muirear gach adamh eile sa chomhdhúil, agus ansin, ó mhuirear iomlán aitheanta an chomhdhúil, ríomh staid ocsaídiúcháin an adaimh seo. - Mar shampla, sa chomhdhúil Na2SO4 ní fios muirear an adaimh sulfair (S) - níl a fhios againn ach nach nialas é, ós rud é nach bhfuil sulfair i stát tosaigh. Is sampla maith é an comhdhúil seo chun an modh ailgéabrach chun an stát ocsaídiúcháin a chinneadh a léiriú.
 2 Faigh staid ocsaídiúcháin na ndúl atá fágtha sa chomhdhúil. Agus na rialacha a thuairiscítear thuas á n-úsáid agat, faigh staid ocsaídiúcháin na n-adamh atá fágtha sa chomhdhúil. Ná déan dearmad faoi na heisceachtaí ón riail le haghaidh O, H, agus mar sin de.
2 Faigh staid ocsaídiúcháin na ndúl atá fágtha sa chomhdhúil. Agus na rialacha a thuairiscítear thuas á n-úsáid agat, faigh staid ocsaídiúcháin na n-adamh atá fágtha sa chomhdhúil. Ná déan dearmad faoi na heisceachtaí ón riail le haghaidh O, H, agus mar sin de. - Do Na2SO4, agus ár rialacha á n-úsáid againn, feicimid gurb é +1 lucht (agus mar sin staid ocsaídiúcháin) na n-ian Na, agus is é -2 gach adamh ocsaigine.
 3 Déan líon na n-adamh a iolrú faoina staid ocsaídiúcháin. Anois go bhfuil stáit ocsaídiúcháin gach adamh ar eolas againn seachas ceann amháin, is gá a chur san áireamh go bhféadfadh roinnt adamh a bheith ag roinnt eilimintí. Déan líon na n-adamh de gach eilimint a iolrú (léirítear é i bhfoirmle cheimiceach an chomhdhúil mar shíntiús de réir shiombail na dúile) faoina staid ocsaídiúcháin.
3 Déan líon na n-adamh a iolrú faoina staid ocsaídiúcháin. Anois go bhfuil stáit ocsaídiúcháin gach adamh ar eolas againn seachas ceann amháin, is gá a chur san áireamh go bhféadfadh roinnt adamh a bheith ag roinnt eilimintí. Déan líon na n-adamh de gach eilimint a iolrú (léirítear é i bhfoirmle cheimiceach an chomhdhúil mar shíntiús de réir shiombail na dúile) faoina staid ocsaídiúcháin. - I Na2SO4 tá 2 adamh Na agus 4 adamh O againn. Dá bhrí sin, ag iolrú 2 × +1, faigheann muid staid ocsaídiúcháin gach adamh Na (2), agus iolraíonn muid 4 × -2 - staid ocsaídiúcháin na n-adamh O (-8).
 4 Cuir suas na torthaí roimhe seo. Ag achoimre ar thorthaí an iolraithe, faigheann muid staid ocsaídiúcháin an chomhdhúil sin ag cur san áireamh rannchuidiú an adaimh atá ag teastáil.
4 Cuir suas na torthaí roimhe seo. Ag achoimre ar thorthaí an iolraithe, faigheann muid staid ocsaídiúcháin an chomhdhúil sin ag cur san áireamh rannchuidiú an adaimh atá ag teastáil. - In ár sampla, do Na2SO4 cuirimid 2 agus -8 leis agus faighimid -6.
 5 Faigh an stát ocsaídiúcháin anaithnid ó lucht an chomhdhúil. Tá na sonraí go léir agat anois chun an staid ocsaídiúcháin atá uait a ríomh go héasca. Scríobh cothromóid, ar a thaobh clé a mbeidh suim na huimhreach a fuarthas sa chéim ríofa roimhe seo agus an staid ocsaídiúcháin anaithnid, agus ar an taobh dheis de mhuirear iomlán an chomhdhúil. I bhfocail eile, (Suim na stát ocsaídiúcháin aitheanta) + (an staid ocsaídiúcháin atá ag teastáil) = (luchtú comhdhúile).
5 Faigh an stát ocsaídiúcháin anaithnid ó lucht an chomhdhúil. Tá na sonraí go léir agat anois chun an staid ocsaídiúcháin atá uait a ríomh go héasca. Scríobh cothromóid, ar a thaobh clé a mbeidh suim na huimhreach a fuarthas sa chéim ríofa roimhe seo agus an staid ocsaídiúcháin anaithnid, agus ar an taobh dheis de mhuirear iomlán an chomhdhúil. I bhfocail eile, (Suim na stát ocsaídiúcháin aitheanta) + (an staid ocsaídiúcháin atá ag teastáil) = (luchtú comhdhúile).- Is é ár gcás, Na2SO4 tá an chuma ar an réiteach mar seo:
- (Suim na stát ocsaídiúcháin is eol) + (an stát ocsaídiúcháin atá ag teastáil) = (muirear cumaisc)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2SO4 tá stát ocsaídiúcháin ag sulfair 6.
- Is é ár gcás, Na2SO4 tá an chuma ar an réiteach mar seo:
Leideanna
- I gcomhdhúile, caithfidh suim gach stáit ocsaídiúcháin an lucht a chomhionannú. Mar shampla, más ian diatómach é an comhdhúil, caithfidh suim stáit ocsaídiúcháin na n-adamh a bheith comhionann leis an muirear ianach iomlán.
- Tá sé an-úsáideach a bheith in ann an tábla peiriadach a úsáid agus fios a bheith agat cá bhfuil na heilimintí miotalacha agus neamh-mhiotalacha suite ann.
- Tá staid ocsaídiúcháin na n-adamh i bhfoirm bhunaidh nialas i gcónaí. Tá staid ocsaídiúcháin ian aonair cothrom lena lucht. Tá staid ocsaídiúcháin +1 ag gnéithe de ghrúpa 1A den tábla peiriadach, mar shampla hidrigin, litiam, sóidiam, i bhfoirm eiliminteach; Is é +2 staid ocsaídiúcháin mhiotail Ghrúpa 2A, mar mhaignéisiam agus cailciam, i bhfoirm eiliminteach. Is féidir le 2 staid ocsaídiúcháin éagsúla a bheith ag ocsaigin agus hidrigin, ag brath ar an gcineál banna ceimiceach.
Céard atá ag teastáil uait
- Tábla tréimhsiúil eilimintí
- Rochtain ar an Idirlíon nó leabhair thagartha ceimice
- Bileog páipéir, peann nó peann luaidhe
- Áireamhán



