Údar:
Randy Alexander
Dáta An Chruthaithe:
1 Mí Aibreáin 2021
An Dáta Nuashonraithe:
1 Iúil 2024
Ábhar
Sa cheimic, leictreoin faoisimh is leictreoin iad atá suite sa chiseal is forimeallaí de bhlaosc leictreon eiliminte. Is teicníc thábhachtach sa cheimic líon na leictreon faoisimh d’eilimint a chinneadh toisc go gcuideoidh an fhaisnéis seo leis na cineálacha bannaí is féidir leis an eilimint sin a fhoirmiú. Is furasta líon na leictreon faoisimh a chinneadh le tábla tréimhsiúil na n-eilimintí ceimiceacha.
Céimeanna
Cuid 1 de 2: Faigh líon na leictreon faoisimh ag baint úsáide as an tábla peiriadach
Le miotal neamh-aistrithe
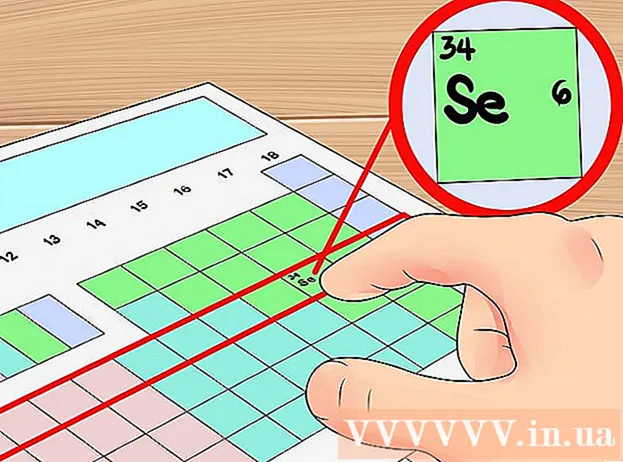
Bíodh ceann réidh agat tábla peiriadach eilimintí ceimiceacha. Is é atá i dtábla tréimhsiúil na n-eilimintí (an tábla peiriadach gairid) tábla ilchill dathchódaithe a liostaíonn na heilimintí go léir atá ar eolas chomh maith le roinnt faisnéise riachtanacha faoi na heilimintí sin. Bunaithe ar an bhfaisnéis atá ar fáil sa tábla peiriadach, is féidir linn líon na leictreon faoisimh den eilimint atá á imscrúdú againn a chinneadh. Is gnách go mbíonn an tábla peiriadach ceangailte le téacsleabhar. Is féidir leat tagairt a dhéanamh freisin don tábla tréimhsiúil idirghníomhach atá ann cheana.

Líon gach colún sa tábla peiriadach ó 1 go 18. De ghnáth sa tábla peiriadach, beidh an líon céanna leictreon faoisimh ag gach eilimint sa cholún céanna. Mura bhfuil colúin uimhrithe ag do thábla tréimhsiúil fós, déan é féin trí 1 go 18 a uimhriú go hingearach ó chlé go deas. Go heolaíoch, tugtar ceann ar gach colún sa tábla peiriadach "grúpa".- Mar shampla, maidir le tábla tréimhsiúil gan síniú, dhéanfaimis uimhir 1 os cionn an eilimint Hidrigin (H), an uimhir 2 os cionn eilimint Beri (Be) agus dhéanfaimis an rud céanna go dtí 18 os cionn Héiliam (He ).

Faigh suíomh na heiliminte atá i gceist. Sa chéim seo faigh amach suíomh na heiliminte a bhfuil tú ag féachaint air ar an tábla peiriadach. Is féidir leat suíomh eilimint a fháil bunaithe ar a siombail cheimiceach (litir i ngach cill), uimhir adamhach (an uimhir sa chúinne uachtarach ar chlé de gach cill), nó bunaithe ar fhaisnéis tá teachtaireachtaí ar fáil ar an tábla peiriadach.- Mar shampla, caithfimid líon na leictreon faoisimh den eilimint a fháil Carbón (C). Is é uimhir adamhach na heiliminte ná 6. Tá an carbón sa chuid uachtarach den ghrúpa 14 eilimint. Sa chéad chéim eile socróimid líon na leictreon faoisimh den eilimint seo.
- Sa chuid seo tabharfaimid neamhaird ar Mhiotail Aistrithe, ie eilimintí i raon grúpaí 3 go 12. Tá na miotail trasdula seo beagán difriúil ón gcuid eile, mar sin tá na céimeanna Ní bhaineann na treoracha a thugtar san alt seo le miotail den sórt sin. Féachfaimid ar na grúpaí eilimintí seo níos déanaí san alt.

Úsáid uimhir an ghrúpa chun líon na leictreon faoisimh a fháil amach. Is féidir uimhir ghrúpa miotail neamh-thrasdula a úsáid chun líon na leictreon faoisimh in adamh an eilimint sin a ríomh. Is é an “tsraith aonaid d’uimhir ghrúpa” líon na leictreon faoisimh in adamh na n-eilimintí sa ghrúpa sin. I bhfocail eile:- Leictreon faoisimh Ghrúpa 1: 1
- Grúpa 2: 2 leictreon faoisimh
- Grúpa 13: 3 leictreon faoisimh
- Grúpa 14: 4 leictreon faoisimh
- Grúpa 15: 5 leictreon faoisimh
- Grúpa 16: 6 leictreon faoisimh
- Grúpa 17: 7 leictreon faoisimh
- Grúpa 18: 8 leictreon faoisimh (seachas héiliam le 2 leictreon faoisimh)
- Sa sampla carbóin, ós rud é go bhfuil an carbón i ngrúpa 14, d’fhéadfaimis a rá go bhfuil adamh carbóin ann ceithre leictreon faoisimh.
Le miotal trasdula
Sainaithin gné sa raon ó Ghrúpa 3 go Grúpa 12. Mar a luadh thuas, tugtar “miotail trasdula” ar na heilimintí i ngrúpaí 3 go 12 agus maidir le leictreoin faoisimh tá airíonna difriúla acu seo ón gcuid eile. Sa chuid seo, foghlaimeoimid cén fáth nach féidir go minic leictreoin faoisimh a shannadh d’adamh miotal trasdula.
- Sa chuid seo glacaimid leis an eilimint Tantan (Ta) a bhfuil a uimhir adamhach 73 mar shampla. Cuideoidh na chéad chéimeanna eile le líon na leictreon faoisimh a chinneadh.
- Tabhair faoi deara go mbaineann na heilimintí de na 3 lantans teaghlaigh agus actinium (ar a dtugtar na "miotail neamhchoitianta talún" freisin) leis an ngrúpa de mhiotail trasdula - is gnách go liostaítear an dá ghrúpa eilimintí seo faoin tábla peiriadach. ceann le lantan agus actini.
Ní hionann leictreoin faoisimh i miotail trasdula agus 'gnáth-leictreoin faoisimh'. Chun a thuiscint cén fáth nach ndéanann miotail trasdula '' obair '' cosúil le heilimintí eile ar an tábla peiriadach, caithfimid beagán a fháil amach faoin gcaoi a n-oibríonn leictreoin san adamh mar a mhínítear thíos. , nó is féidir leat an chéim seo a scipeáil.
- Nuair a chuirtear leictreoin isteach in adamh, socraítear iad i “bhfithiseáin” éagsúla - is é sin, réigiúin éagsúla timpeall an núicléas. I mbeagán focal, is iad leictreoin faoisimh na leictreoin atá suite i bhfithiseach na sraithe is forimeallaí - is é sin le rá, na leictreoin dheireanacha a chuirtear leis an adamh.
- B’fhéidir go bhfuil sé beagán casta an fithiseach a mhíniú go mion, nuair a chuirtear leictreoin leis an bhfo-aicme d de bhlaosc adamhach na miotal trasdula (féach thíos), beidh an chéad cheann de na leictreoin seo ag iompar mar ghnáth-leictreoin faoisimh, ach ansin is féidir a n-airíonna a athrú, a dhúbailt nuair is féidir le leictreoin ó fhithiseáin eile gníomhú mar leictreoin faoisimh. Is é sin, is féidir le adamh leictreoin ilfhada a bheith ag brath ar an gcás.
- Is féidir leat níos mó a fhoghlaim faoi seo ar shuíomh leictreon faoisimh Coláiste Pobail Clackamas.
Faigh líon na leictreon faoisimh bunaithe ar uimhir an ghrúpa. Mar a luadh thuas maidir le miotail neamh-aistrithe, is féidir leis an uimhir ghrúpa ar an tábla peiriadach cuidiú le líon na leictreon faoisimh a chinneadh. Mar sin féin, níl aon fhoirmle chinnte ann chun líon cruinn na leictreon faoisimh sa mhiotal trasdula a chinneadh - sa chás seo, níl líon na leictreon faoisimh d’eilimint ag luach seasta, líon na rudaí. ní féidir le féinghrúpaí ach líon coibhneasta leictreon faoisimh a insint. Sonraí:
- Grúpa 3: 3 leictreon faoisimh
- Grúpaí de leictreoin faoisimh 4: 2 go 4
- Grúpa 5: 2 go 5 leictreon faoisimh
- Grúpa 6: 2 go 6 leictreon faoisimh
- Grúpaí 7: 2 go 7 leictreon faoisimh
- Grúpaí de leictreoin faoisimh 8: 2 go 3
- Grúpaí 9: 2 go 3 leictreon faoisimh
- Grúpaí de leictreoin faoisimh 10: 2 go 3
- Grúpaí 11: 1 go 2 leictreon faoisimh
- Grúpa 12: 2 leictreon faoisimh
- Ag glacadh sampla den eilimint Tanta (Ta) de ghrúpa 5, is féidir linn a rá go bhfuil ag an eilimint seo ó 2 go 5 leictreon faoisimh, ag brath ar an gcás.
Cuid 2 de 2: Faigh líon na leictreon faoisimh bunaithe ar chumraíocht leictreon
Faigh amach conas cumraíocht leictreon a léamh. Bunaithe ar chumraíocht leictreon eilimint, is féidir linn líon na leictreon faoisimh den eilimint sin a chinneadh. Tá cuma chasta ar chumraíocht leictreon, ach níl ann ach conas fithiseáin eiliminte a léiriú i bhfoirm litreacha agus uimhreacha, nuair a bhíonn an dlí glactha agat, níl sé deacair cumraíocht leictreon a thuiscint.
- Smaoinigh ar shampla cumraíocht leictreon sóidiam (Na):
- 1s2s2p3s
- Má thugann tú aird, feicfidh tú nach bhfuil sa chumraíocht leictreon ach sreang athrá:
- (uimhir) (focal) (uimhir) (focal) ...
- ... agus mar sin de. Grúpa (uimhir) (focal) is é an chéad cheann ainm an fhithiseáin agus seasann sé líon na leictreon san fhithiseach sin.
- Mar sin, inár gcás féin, is féidir linn a rá go ndéanann sóidiam 2 leictreon i bhfithiseach 1s, 2 leictreon i bhfithiseach 2s, 6 leictreon san fhithiseach 2p agus 1 leictreon i bhfithiseach 3 3s. 11 leictreon san iomlán - is é 11 uimhir adamhach sóidiam.
- Smaoinigh ar shampla cumraíocht leictreon sóidiam (Na):
Faigh cumraíocht leictreon na heiliminte a bhfuil tú ag féachaint air. A luaithe is atá cumraíocht leictreon eilimint ar eolas agat, níl sé deacair cumraíocht leictreon na heiliminte sin a fháil (ach amháin i gcás miotail trasdula). Má tá cumraíocht na leictreon ar fáil sa cheist a chaithfidh tú a réiteach, is féidir leat an chéim seo a scipeáil. Más gá duit cumraíocht na leictreon a fháil, lean ar aghaidh leis na céimeanna seo a leanas:
- Is é cumraíocht iomlán leictreon na dúile ununocti (Uuo), an uimhir adamhach 118:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Nuair a bheidh cumraíocht iomlán leictreon den sórt sin agat, chun cumraíocht leictreon eilimint eile a fháil, ní gá duit ach na fithiseáin a líonadh le leictreoin, ag tosú ón gcéad fhithiseach, go dtí go mbeidh líon na leictreon caite le líonadh. Fuaimeann sé casta, ach maidir le é a dhéanamh tá sé réasúnta éasca. Mar shampla, dá mbeimis ag iarraidh cumraíocht iomlán leictreon clóirín (Cl), eilimint 17 a scríobh, is é sin, tá 17 leictreon ag adamh an eilimint seo, líonfaimis an méid seo a leanas:
- 1s2s2p3s3p
- Tabhair faoi deara go bhfuil líon iomlán na leictreon i gcumraíocht leictreon díreach i gceart 17: 2 + 2 + 6 + 2 + 5 = 17. Ní gá duit ach an uimhir a athrú ar an bhfithiseach deireanach - fanann an chuid eile mar an gcéanna toisc go bhfuil an fithiseach beagnach leathdhéanach iomlán. leictreon.
- Faigh tuilleadh eolais faoi conas cumraíocht leictreon eiliminte a scríobh.
- Is é cumraíocht iomlán leictreon na dúile ununocti (Uuo), an uimhir adamhach 118:

Leictreoin a shannadh do fhithiseáin de réir an Ochtú Riail. Nuair a chuirtear leictreoin le adamh, déantar iad a shórtáil ina bhfithiseáin san ord a luaitear thuas - cuirfear an chéad dá leictreon i bhfithiseán 1s, cuirfear an chéad dá leictreon eile i bhfithiseán 2s, cuirtear na chéad sé leictreon eile san fhithiseach 2p, déan amhlaidh go dtí go gcuirtear an leictreon san fhithiseach comhfhreagrach. Nuair a dhéanaimid machnamh ar adamh na n-eilimintí neamh-aistrithe, is féidir linn a rá go gcruthóidh na fithiseáin seo “sraitheanna” timpeall an núicléas, ina mbeidh an ciseal cúil níos faide ón núicléas ná an ceann a bhí roimhe. Chomh maith leis an gcéad chiseal fithiseach nach féidir ach suas le dhá leictreon a choinneáil, is féidir le gach ciseal fithiseach ina dhiaidh sin suas le hocht leictreon a choinneáil (ach amháin i gcás miotail trasdula). Tugtar an riail seo An Riail Ocht huaire.- Mar shampla, smaoinigh ar an eilimint Bo (B). Is é 5 uimhir adamhach na dúile seo, mar sin tá cumraíocht leictreon na heiliminte seo againn mar a leanas: 1s2s2p. Ós rud é nach bhfuil ach 2 leictreon sa chéad bhlaosc fithiseach, is féidir a chinneadh go bhfuil dhá shraith fithise ag Bo: an chéad cheann comhdhéanta de 2 leictreon ag fithiseán 1s agus an dara ceann le trí leictreon dáilte sna fithiseáin 2s agus 2p. .
- Mar shampla eile, bheadh trí shraith ag eilimint cosúil le clóirín: sraith de dhá leictreon i bhfithiseach 1s, ciseal dhá leictreon i bhfithiseach 2s agus sé leictreon san fhithiseach 2p, agus ciseal seachtrach dhá leictreon sa 3 fhithiseach. agus cúig leictreon i bhfithiseach 3p.

Faigh líon na leictreon sa chiseal is forimeallaí. Nuair a bheidh cumraíocht na leictreon socraithe, tá a fhios againn cheana féin sraitheanna na dúile sin, agus is féidir líon na leictreon faoisimh a fháil trí líon na leictreon sa chiseal is forimeallaí den bhlaosc leictreon adamhach a chinneadh. Má tá an ciseal is forimeallaí lán (ie cheana féin le hocht leictreon san iomlán, nó don chéad chiseal 2 leictreon) ansin tugtar eilimint támh ar an eilimint sin agus is ar éigean a bhíonn baint aici le frithghníomhartha ceimiceacha. Mar sin féin, ní bhaineann an riail seo le miotail trasdula.- Mar shampla Bo, ós rud é go bhfuil trí leictreon ag Bo sa dara sraith, an ciseal is forimeallaí freisin, ionas gur féidir linn a rá go bhfuil eilimint Bo ann athair leictreoin faoisimh.

Úsáid an tsraithuimhir ar an tábla peiriadach mar bhealach giorraithe chun líon na sraitheanna fithise a chinneadh. Tugtar an tsraith chothrománach ar an tábla peiriadach "timthriall" de na heilimintí. Ag tosú ón gcéad shraith, freagraíonn gach timthriall do ‘líon na sraitheanna leictreon’ de na dúile sa tréimhse chéanna. Dá bhrí sin, is féidir leat an tréimhse a úsáid chun líon na leictreon faoisimh d’eilimint a chinneadh go tapa - ní dhéanann tú ach líon na leictreon a chomhaireamh in ord ó chlé go deas ón gcéad eilimint den tréimhse sin. Tabhair faoi deara arís nach bhfuil sé seo infheidhme maidir le miotail trasdula.- Mar shampla, ós rud é go mbaineann seiléiniam le timthriall 4, is féidir a chinneadh go bhfuil ceithre shraith leictreon sa bhlaosc adamhach san eilimint. Ós rud é in ord ó chlé go deas, is é seo an séú heilimint i dtimthriall 4 (gan an miotal trasdula a áireamh), is féidir linn a rá go bhfuil sé leictreon sa cheathrú blaosc seiléiniam, i.e. sé leictreon faoisimh.
Comhairle
- Tabhair faoi deara, is féidir cumraíocht an leictreon a scríobh go hachomair trí gháis neamhchoitianta (eilimintí de ghrúpa 18) a úsáid in ionad fithiseán ag barr na cumraíochta. Mar shampla, is féidir cumraíocht leictreon sóidiam a scríobh mar 3s1 - is é sin, tá cumraíocht leictreon sóidiam mar an gcéanna le cumraíocht Neon ach tá leictreon breise san fhithiseach 3s.
- D’fhéadfadh go mbeadh fo-aicmí neamhiomlána faoisimh ag miotail aistrithe. D’fhonn uimhir fhaoisimh na miotal trasdula a chinneadh go cruinn, is gá prionsabail chandamach chasta a úsáid nach gcumhdaítear leis an alt seo.
- Tá sé tábhachtach a thabhairt faoi deara gur féidir leis an tábla peiriadach d’eilimintí ceimiceacha a bheith difriúil i dtíortha éagsúla. Mar sin, déan cinnte go bhfuil tú ag úsáid an tábla thréimhsiúil choitinn ina gcónaíonn tú chun mearbhall a sheachaint.
Cad atá uait
- Tábla tréimhsiúil eilimintí ceimiceacha
- Peann luaidhe
- Páipéar