Údar:
Virginia Floyd
Dáta An Chruthaithe:
6 Lúnasa 2021
An Dáta Nuashonraithe:
1 Iúil 2024
Ábhar
- Céimeanna
- Modh 1 de 3: Na Basics
- Modh 2 de 3: Cineál an bhanna a chinneadh trí leictridhiúltacht
- Modh 3 de 3: Leictridhiúltacht Mulliken a ríomh
- Leideanna
Sa cheimic, is é leictridhiúltacht cumas adamh leictreoin a mhealladh ó adamh eile chucu. Meallann adamh a bhfuil ard-leictridhiúltacht leictreoin aige go láidir, agus meallann adamh a bhfuil leictridhiúltacht íseal leictreoin go lag. Úsáidtear luachanna leictridhiúltachta chun iompar adamh éagsúil i gcomhdhúile ceimiceacha a thuar.
Céimeanna
Modh 1 de 3: Na Basics
 1 Bannaí ceimiceacha. Tagann bannaí den sórt sin chun cinn nuair a bhíonn leictreoin in adamh ag idirghníomhú lena chéile, is é sin, bíonn dhá leictreon (ceann ó gach adamh) coitianta.
1 Bannaí ceimiceacha. Tagann bannaí den sórt sin chun cinn nuair a bhíonn leictreoin in adamh ag idirghníomhú lena chéile, is é sin, bíonn dhá leictreon (ceann ó gach adamh) coitianta. - Tá tuairisc ar na cúiseanna le hidirghníomhú leictreon in adamh lasmuigh de scóip an ailt seo.Le haghaidh tuilleadh faisnéise ar an ábhar seo, léigh, mar shampla, an t-alt seo.
 2 Éifeacht leictridhiúltacht. Nuair a mheallann dhá adamh leictreoin a chéile, ní hionann fórsa an tarraingthe. Meallann adamh a bhfuil leictridhiúltacht níos airde aige dhá leictreon níos láidre. Meallann adamh le leictridhiúltacht an-ard leictreoin a bhfuil a leithéid de fhórsa acu nach bhfuilimid ag caint faoi leictreoin chomhroinnte a thuilleadh.
2 Éifeacht leictridhiúltacht. Nuair a mheallann dhá adamh leictreoin a chéile, ní hionann fórsa an tarraingthe. Meallann adamh a bhfuil leictridhiúltacht níos airde aige dhá leictreon níos láidre. Meallann adamh le leictridhiúltacht an-ard leictreoin a bhfuil a leithéid de fhórsa acu nach bhfuilimid ag caint faoi leictreoin chomhroinnte a thuilleadh. - Mar shampla, sa mhóilín NaCl (clóiríd sóidiam, salann coitianta), tá leictridhiúltacht measartha ard ag an adamh clóirín, agus tá an adamh sóidiam sách íseal. Mar sin leictreoin a mhealltar chuig an adamh clóirín agus adamh sóidiam a aischur.
 3 Tábla leictridhiúltachta. Cuimsíonn an tábla seo eilimintí ceimiceacha a eagraítear ar an mbealach céanna agus a dhéantar sa tábla peiriadach, ach tugtar leictridhiúltacht a adamh do gach eilimint. Is féidir tábla den sórt sin a fháil i dtéacsleabhair cheimic, ábhair thagartha, agus ar an ngréasán.
3 Tábla leictridhiúltachta. Cuimsíonn an tábla seo eilimintí ceimiceacha a eagraítear ar an mbealach céanna agus a dhéantar sa tábla peiriadach, ach tugtar leictridhiúltacht a adamh do gach eilimint. Is féidir tábla den sórt sin a fháil i dtéacsleabhair cheimic, ábhair thagartha, agus ar an ngréasán. - Gheobhaidh tú tábla leictridhiúltachta den scoth anseo. Tabhair faoi deara go n-úsáideann sé scála leictridhiúltacht Pauling, an ceann is coitianta. Mar sin féin, tá bealaí eile ann chun leictridhiúltacht a ríomh, agus pléifear ceann acu thíos.
 4 Treochtaí leictridhiúltachta. Mura bhfuil tábla leictridhiúltachta agat idir lámha, is féidir leat leictridhiúltacht adamh a mheas de réir shuíomh eilimint sa tábla peiriadach.
4 Treochtaí leictridhiúltachta. Mura bhfuil tábla leictridhiúltachta agat idir lámha, is féidir leat leictridhiúltacht adamh a mheas de réir shuíomh eilimint sa tábla peiriadach. - Conas ar dheis tá an eilimint suite, an níos mó leictridhiúltacht a adamh.
- Conas níos airde tá an eilimint suite, an níos mó leictridhiúltacht a adamh.
- Dá bhrí sin, tá na leictridhiúltachtaí is airde ag adamh na ndúl atá suite sa chúinne uachtarach ar dheis den tábla peiriadach, agus tá na hadaimh is ísle ag adamh na n-eilimintí atá suite sa chúinne íochtarach ar chlé.
- In ár sampla NaCl, is féidir linn a rá go bhfuil leictridhiúltacht níos airde ag clóirín ná sóidiam, toisc go bhfuil clóirín suite ar thaobh na láimhe deise de sóidiam.
Modh 2 de 3: Cineál an bhanna a chinneadh trí leictridhiúltacht
 1 Ríomh an difríocht idir leictridhiúltachtaí dhá adamh chun tréithe an bhanna eatarthu a thuiscint. Chun seo a dhéanamh, bain an leictridhiúltacht níos lú ón gceann is mó.
1 Ríomh an difríocht idir leictridhiúltachtaí dhá adamh chun tréithe an bhanna eatarthu a thuiscint. Chun seo a dhéanamh, bain an leictridhiúltacht níos lú ón gceann is mó. - Mar shampla, smaoinigh ar an móilín HF. Dealaigh leictridhiúltacht hidrigine (2.1) ó leictridhiúltacht fluairín (4.0): 4.0 - 2.1 = 1,9.
 2 Má tá an difríocht níos lú ná 0.5, ansin tá an banna comhfhiúsach neamhpholar, ina mealltar leictreoin leis an neart céanna beagnach. Cruthaítear bannaí den sórt sin idir dhá adamh comhionanna. De ghnáth bíonn sé an-deacair naisc neamhpholacha a bhriseadh. Tá sé seo toisc go roinneann adamh leictreoin, rud a fhágann go bhfuil a mbanna seasmhach. Tógann sé go leor fuinnimh chun é a scriosadh.
2 Má tá an difríocht níos lú ná 0.5, ansin tá an banna comhfhiúsach neamhpholar, ina mealltar leictreoin leis an neart céanna beagnach. Cruthaítear bannaí den sórt sin idir dhá adamh comhionanna. De ghnáth bíonn sé an-deacair naisc neamhpholacha a bhriseadh. Tá sé seo toisc go roinneann adamh leictreoin, rud a fhágann go bhfuil a mbanna seasmhach. Tógann sé go leor fuinnimh chun é a scriosadh. - Mar shampla, an móilín O.2 tá an cineál seo nasc aige. Ós rud é go bhfuil an leictridhiúltacht chéanna ag dhá adamh ocsaigine, is é 0 an difríocht eatarthu.
 3 Má tá an difríocht sa raon 0.5 - 1.6, ansin tá an banna polach comhfhiúsach. Sa chás seo, meallann ceann amháin den dá adamh leictreoin níos láidre agus dá bhrí sin faigheann sé muirear páirteach diúltach, agus an ceann eile muirear páirteach dearfach. Ligeann an éagothroime muirir seo don mhóilín páirt a ghlacadh in imoibrithe áirithe.
3 Má tá an difríocht sa raon 0.5 - 1.6, ansin tá an banna polach comhfhiúsach. Sa chás seo, meallann ceann amháin den dá adamh leictreoin níos láidre agus dá bhrí sin faigheann sé muirear páirteach diúltach, agus an ceann eile muirear páirteach dearfach. Ligeann an éagothroime muirir seo don mhóilín páirt a ghlacadh in imoibrithe áirithe. - Mar shampla, an móilín H.2Tá an cineál banna seo ag O (uisce). Tá an t-adamh O níos leictridhiúltacha ná dhá adamh H, mar sin meallann ocsaigin leictreoin níos láidre agus faigheann sé muirear páirteach diúltach, agus hidrigin - muirear páirteach dearfach.
 4 Má tá an difríocht níos mó ná 2.0, ansin tá an banna ianach. Is banna é seo ina dtéann an péire leictreon coiteann go príomha chuig adamh le leictridhiúltacht níos airde, a fhaigheann muirear diúltach, agus faigheann adamh a bhfuil leictridhiúltacht níos ísle aige muirear dearfach. Imoibríonn móilíní le bannaí den sórt sin go maith le hadaimh eile agus is féidir le hadaimh pholacha iad a scriosadh.
4 Má tá an difríocht níos mó ná 2.0, ansin tá an banna ianach. Is banna é seo ina dtéann an péire leictreon coiteann go príomha chuig adamh le leictridhiúltacht níos airde, a fhaigheann muirear diúltach, agus faigheann adamh a bhfuil leictridhiúltacht níos ísle aige muirear dearfach. Imoibríonn móilíní le bannaí den sórt sin go maith le hadaimh eile agus is féidir le hadaimh pholacha iad a scriosadh. - Mar shampla, tá an cineál banna seo ag an móilín NaCl (clóiríd sóidiam).Tá an t-adamh clóirín chomh leictreamaighnéadach go meallann sé an dá leictreon chuige féin agus go bhfaigheann sé lucht diúltach, agus faigheann an t-adamh sóidiam lucht dearfach.
- Is féidir NaCl a scriosadh le móilín polarach mar H2O (uisce). I móilín uisce, tá taobh hidrigine an mhóilín dearfach agus tá an taobh ocsaigine diúltach. Má mheascann tú salann le huisce, déanann na móilíní uisce na móilíní salainn a bhriseadh síos, rud a fhágann go ndíscaoileann sé.
 5 Má tá an difríocht idir 1.6 agus 2.0, déan seiceáil le haghaidh miotail. Má tá adamh miotail i láthair i móilín, ansin tá an banna ianach. Mura bhfuil aon adamh miotail sa mhóilín, ansin tá an banna comhfhiúsach polach.
5 Má tá an difríocht idir 1.6 agus 2.0, déan seiceáil le haghaidh miotail. Má tá adamh miotail i láthair i móilín, ansin tá an banna ianach. Mura bhfuil aon adamh miotail sa mhóilín, ansin tá an banna comhfhiúsach polach. - Tá miotail suite ar thaobh na láimhe clé agus i lár an tábla thréimhsiúil. Sa tábla seo, leagtar béim ar mhiotail.
- In ár sampla HF, tagann an difríocht idir leictridhiúltachtaí laistigh den raon seo. Ós rud é nach miotail iad H agus F, an banna comhfhiúsach polach.
Modh 3 de 3: Leictridhiúltacht Mulliken a ríomh
 1 Faigh an chéad fhuinneamh ianúcháin d'adamh. Tá scála leictridhiúltacht Mulliken beagáinín difriúil ón scála Pauling a luaitear thuas. Teastaíonn an chéad fhuinneamh ianúcháin chun adamh amháin a bhaint as leictreon.
1 Faigh an chéad fhuinneamh ianúcháin d'adamh. Tá scála leictridhiúltacht Mulliken beagáinín difriúil ón scála Pauling a luaitear thuas. Teastaíonn an chéad fhuinneamh ianúcháin chun adamh amháin a bhaint as leictreon. - Is féidir brí an fhuinnimh sin a fháil i leabhair thagartha ceimice nó ar an glan, mar shampla, anseo.
- Mar shampla, lig dúinn leictridhiúltacht litiam (Li) a fháil. Is é a chéad fhuinneamh ianúcháin 520 kJ / mol.
 2 Faigh fuinneamh cleamhnais leictreon. Seo an fuinneamh a scaoiltear sa phróiseas chun leictreon a cheangal le adamh. Is féidir brí an fhuinnimh sin a fháil i leabhair thagartha ceimice nó ar an glan, mar shampla, anseo.
2 Faigh fuinneamh cleamhnais leictreon. Seo an fuinneamh a scaoiltear sa phróiseas chun leictreon a cheangal le adamh. Is féidir brí an fhuinnimh sin a fháil i leabhair thagartha ceimice nó ar an glan, mar shampla, anseo. - Is é fuinneamh cleamhnais leictreon litiam 60 kJ / mol.
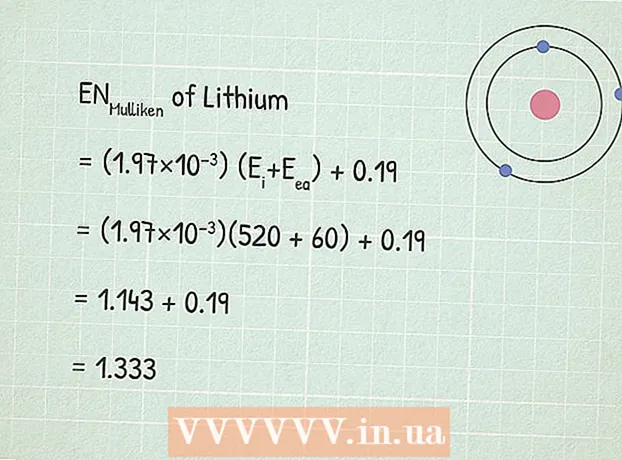
 3 Úsáid cothromóid leictridhiúltachta Mulliken:RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19.
3 Úsáid cothromóid leictridhiúltachta Mulliken:RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19. - In ár sampla:
- RUMulliken = (1.97 × 10) (E.i+ E.ea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- In ár sampla:
Leideanna
- Chomh maith leis na scálaí Pauling agus Mulliken, tá scálaí leictridhiúltachta ann de réir Allred-Rochow, Sanderson, Allen. Tá a bhfoirmlí féin ag gach duine acu chun leictridhiúltacht a ríomh (tá cuid acu casta go leor).
- Níl aon aonaid tomhais ag leictridhiúltacht.