Údar:
Lewis Jackson
Dáta An Chruthaithe:
12 Bealtaine 2021
An Dáta Nuashonraithe:
1 Iúil 2024
Ábhar
Cumraíocht leictreon sraith uimhreacha d’adamh a sheasann do na fithiseáin leictreon. Is iad Obitans Leictreon na réigiúin spásúla de chruthanna éagsúla a bhaineann le núicléas an adaimh, ina socraítear leictreoin ar bhealach ordúil. Trí chumraíocht leictreon is féidir leat a chinneadh go tapa cé mhéad fithiseán leictreon atá san adamh, agus líon na leictreon i ngach fithiseach. Chomh luath agus a thuigeann tú bunphrionsabail chumraíocht leictreon, beidh tú in ann do chumraíocht leictreon féin a scríobh agus beidh tú in ann tástálacha ceimiceacha a dhéanamh le muinín.
Céimeanna
Modh 1 de 2: Faigh líon na leictreon ag baint úsáide as tábla peiriadach tréimhsiúil
Faigh uimhir adamhach an adaimh. Tá líon sonrach leictreon ag gach adamh a bhaineann leis. Aimsigh an eilimint ar an tábla peiriadach. Is slánuimhir dearfach í an uimhir adamhach ag tosú ag 1 (le haghaidh hidrigine) agus ag méadú faoi 1 do gach adamh ina dhiaidh sin. Is í an uimhir adamhach líon prótón an adaimh - mar sin is í líon leictreon an adaimh sa stát talún freisin.
- Faigh muirear an adaimh. Tá an líon ceart leictreon ag adamh atá neodrach go leictreach mar a thaispeántar ar an tábla peiriadach. Mar sin féin, beidh níos mó nó níos lú leictreon ag adamh le luchtú bunaithe ar a mhéid luchtaithe. Má tá tú ag obair le hadaimh le muirear, cuir nó dealú an líon comhfhreagrach leictreon: cuir leictreon amháin le haghaidh gach luchtaithe dhiúltaigh agus dealraigh leictreon amháin do gach lucht dearfach.
- Mar shampla, bainfear adamh sóidiam le muirear +1 le leictreon amháin a bhaint den bhun-uimhir adamhach 11. Dá bhrí sin, beidh 10 leictreon san iomlán san adamh sóidiam.
- Cuir an liosta fithiseach bunúsach i gcuimhne. Nuair a fhaigheann adamh leictreoin, socrófar na leictreoin seo ina bhfithiseáin in ord sonrach. Nuair a líonann na leictreoin fithiseáin, tá líon na leictreon i ngach fithiseach cothrom. Tá na fithiseáin seo a leanas againn:
- Obitan s (uimhir ar bith a bhfuil “s” taobh thiar de i gcumraíocht na leictreon) níl ach fithiseach amháin ann, agus lean An Prionsabal Seachas PauliTá 2 leictreon ar a mhéad i ngach fithiseach, mar sin níl ach 2 leictreon i ngach fithiseán.
- Obitan lch tá 3 fhithiseán aige, ionas gur féidir leis suas le 6 leictreon a choinneáil.
- Obitan d tá 5 fhithiseán aige, ionas gur féidir leis suas le 10 leictreon a choinneáil.
- Obitan f tá 7 bhfithiseán ann, mar sin is féidir leo suas le 14 leictreon a choinneáil. Cuir ord na bhfithiseán i gcuimhne de réir na habairte gabhála seo a leanas:
S.ar P.ionsaitheach D.uh F.ceart go leor G.numb H.Úps ÍK.Tagaim.
Maidir le hadaimh a bhfuil níos mó leictreon acu, leanann fithiseáin á scríobh in ord aibítre tar éis na litreach k, ag fágáil amach na gcarachtar a úsáideadh.
- Cumraíocht leictreon a thuiscint. Scríobhtar cumraíochtaí leictreon chun líon na leictreon san adamh a thaispeáint go soiléir, chomh maith le líon na leictreon i ngach fithiseach. Scríobhtar gach fithiseach in ord áirithe, agus tá líon na leictreon i ngach fithiseach scríofa os cionn cheart an ainm fithiseach. Faoi dheireadh is é atá sa chumraíocht leictreon seicheamh ina bhfuil ainmneacha na bhfithiseán agus líon na leictreon atá scríofa thuas ar thaobh na láimhe deise díobh.
- Is é an sampla seo a leanas cumraíocht leictreon simplí: 1s 2s 2p. Taispeánann an chumraíocht seo go bhfuil dhá leictreon i bhfithiseach 1s, dhá leictreon i bhfithiseach 2s, agus sé leictreon san fhithiseach 2p. 2 + 2 + 6 = 10 leictreon (iomlán). Tá an chumraíocht leictreon seo le haghaidh adamh neoin atá neodrach go leictreach (is é uimhir adamhach neon 10).
- Cuir ord na bhfithiseán i gcuimhne. Tabhair faoi deara go bhfuil na fithiseáin uimhrithe de réir aicme na leictreon, ach go ndéantar iad a ordú go fuinniúil. Mar shampla, tá fithiseach 4s sáithithe le fuinneamh níos ísle (nó níos marthanaí) ná an fithiseach 3d sáithithe nó neamhsháithithe, mar sin scríobhtar an fho-aicme 4s ar dtús. Nuair a bheidh ord na bhfithise ar eolas agat, is féidir leat na leictreoin a shocrú iontu de réir líon na leictreon san adamh. Seo a leanas an t-ordú chun leictreoin a chur i bhfithiseáin: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Scríobhtar cumraíocht leictreon adamh le gach fithiseach líonta leictreon mar seo: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Tabhair faoi deara má líontar na sraitheanna go léir, is é cumraíocht Og (Oganesson), 118, an t-adamh uimhrithe is airde ar an tábla peiriadach - ina bhfuil na sraitheanna leictreon uile atá ar eolas faoi láthair le adamh neodrach leictreach.
- Sórtáil leictreoin ina bhfithiseáin de réir líon na leictreon san adamh. Mar shampla, más mian leat cumraíocht leictreon an adaimh chailciam atá neodrach go leictreach a scríobh, is é an chéad rud atá le déanamh ná a uimhir adamhach a fháil ar an tábla peiriadach. Is é 20 an uimhir adamhach cailciam, mar sin scríobhfaimid an chumraíocht d'adamh le 20 leictreon san ord thuas.
- Cuir do leictreoin i bhfithiseáin san ord thuas go dtí go mbeidh 20 leictreon sroichte agat. Faigheann Obitan 1s dhá leictreon, faigheann 2s dhá cheann, faigheann 2p sé cinn, faigheann 3s dhá cheann, faigheann 3p sé cinn, agus faigheann 4s dhá cheann (2 + 2 + 6 +2 +6 + 2 = 20). Mar sin is é cumraíocht leictreon cailciam: 1s 2s 2p 3s 3p 4s.
- Nóta: Athraíonn an leibhéal fuinnimh de réir mar a mhéadaíonn an ciseal leictreon. Mar shampla, nuair a scríobhann tú chuig an 4ú leibhéal fuinnimh, scríobhtar an fho-aicme 4s ar dtús, níos déanaí go 3d. Tar éis duit an ceathrú leibhéal fuinnimh a scríobh, bogfaidh tú ar aghaidh go dtí an cúigiú leibhéal agus atosóidh tú an t-ordú sraitheála. Ní tharlaíonn sé seo ach tar éis an 3ú leibhéal fuinnimh.
- Úsáid an tábla peiriadach mar aicearra amhairc. B’fhéidir gur thug tú faoi deara go bhfreagraíonn cruth an tábla thréimhsiúil d’ord na bhfithiseán i gcumraíocht leictreon. Mar shampla, críochnaíonn adaimh sa dara colún ar chlé i gcónaí ag “s”, críochnaíonn adaimh ar an taobh dheis den lárlíne i gcónaí ag “d”, srl. Úsáid an tábla peiriadach chun struchtúir a scríobh. figiúr - freagróidh an t-ord ina gcuirtear na leictreoin i bhfithiseáin leis na suíomhanna a thaispeántar ar an tábla peiriadach. Féach thíos:
- Is adaimh iad an dá cholún is faide ar chlé a gcríochnaíonn a gcumraíocht leictreon san fhithiseán, adamh atá sa chuid cheart den tábla peiriadach le cumraíocht leictreon ag críochnú san fhithiseán, is é an chuid lár adamh a chríochnaíonn san fhithiseán. d, agus thíos tá na hadaimh a chríochnaíonn san fhithiseán.
- Mar shampla, agus cumraíochtaí leictreon á scríobh agat don eilimint clóirín, déan an argóint seo a leanas: Tá an t-adamh seo sa tríú sraith (nó "tréimhse") den tábla peiriadach. Tá sé freisin sa chúigiú colún den bhloc fithiseach ar an tábla peiriadach. Mar sin críochnóidh cumraíocht an leictreon ... 3p.
- Cúramach! Freagraíonn na haicmí f agus f ar an tábla peiriadach do leibhéil fuinnimh atá difriúil óna dtréimhse. Mar shampla, freagraíonn an chéad tsraith den bhloc fithiseach d don fhithiseach 3d cé go bhfuil sé i dtréimhse 4, agus comhfhreagraíonn an chéad tsraith den fhithiseán fithiseach 4f cé go bhfuil sé i dtréimhse 6.
- Faigh amach cé mar is féidir cumraíochtaí leictreon collapsible a scríobh. Tugtar na hadaimh feadh imeall ceart an tábla thréimhsiúil gás neamhchoitianta. Tá na heilimintí seo an-támh go ceimiceach. Chun an bealach chun cumraíochtaí fada leictreon a scríobh a ghiorrú, scríobh idir lúibíní cearnacha an tsiombail cheimiceach don ghás neamhchoitianta is gaire a bhfuil níos lú leictreon aige ná an adamh, agus ansin lean ort ag scríobh cumraíochtaí leictreon na gcéad fhithiseán eile. . Féach thíos:
- Chun an coincheap seo a thuiscint, scríobh cumraíocht leictreon titim sampla. Cuir i gcás go gcaithfimid an chumraíocht leictreon le haghaidh laghdú since (uimhir adamhach 30) a scríobh trí chumraíocht gáis neamhchoitianta. Is é cumraíocht leictreon iomlán Zinc: 1s 2s 2p 3s 3p 4s 3d. Tabhair faoi deara, áfach, gurb é 1s 2s 2p 3s 3p an chumraíocht don ghás agónach annamh. Cuir an tsiombail cheimiceach agónach idir lúibíní cearnacha () in ionad na coda seo de nodaireacht leictreon sinc.
- Mar sin tá cumraíocht leictreon since dlúth 4s 3d.
Modh 2 de 2: Úsáid an tábla peiriadach ADOMAH

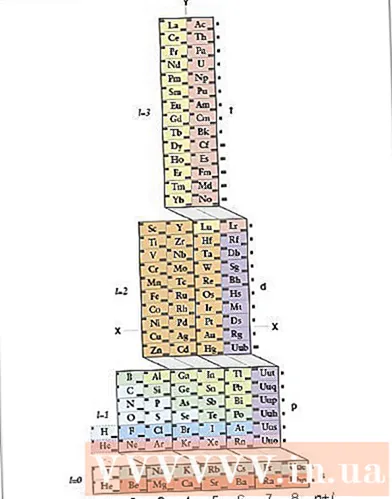
Déan iniúchadh ar thábla tréimhsiúil ADOMAH. Ní gá an modh seo chun cumraíocht leictreon a scríobh a mheabhrú. Éilíonn an modh seo, áfach, tábla tréimhsiúil atheagraithe, mar gheall sa tábla tréimhsiúil rialta, ón gceathrú ró, ní fhreagraíonn líon na dtimthriallta don chiseal leictreon. Faigh Tábla Peiriadach ADOMAH, tábla tréimhsiúil ceimiceach speisialta a dhear an t-eolaí Valery Tsimmerman. Is féidir leat an tábla tréimhsiúil seo a fháil ar an idirlíon.- Ar Tábla Tréimhsiúil ADOMAH, is grúpaí eilimintí iad na sraitheanna cothrománacha cosúil le halaiginí, gáis támh, miotail alcaile, miotal cré alcaileach srl. Freagraíonn na colúin ingearacha don chiseal leictreon agus tugtar "rungs" orthu (acomhail trasnánacha). comhfhreagraíonn bloic s, p, d agus f) don tréimhse.
- Socraítear héiliam in aice le hidrigin toisc go bhfuil fithiseach uathúil 1s ag an dá cheann. Taispeántar na bloic thréimhsiúla (í, p, d agus f) ar an taobh dheis agus taispeántar líon na sraitheanna leictreon ag an mbonn. Scríobhtar ainmneacha eilimintí i ndronuilleog darb uimhir 1 go 120. Is iad na huimhreacha seo na gnáthuimhreacha adamhacha, a léiríonn líon iomlán na leictreon in adamh atá neodrach go leictreach.
- Faigh eilimintí ar an tábla peiriadach ADOMAH. Chun cumraíocht leictreon d’eilimint a scríobh, aimsigh a siombail ar Tábla Tréimhsiúil ADOMAH agus trasnaigh gach eilimint le huimhreacha adamhacha níos airde. Mar shampla, más mian leat cumraíocht leictreon eribi (68) a scríobh, déan eilimintí 69 trí 120 a thrasnú.
- Tabhair faoi deara na huimhreacha 1 go 8 ag bun an tábla thréimhsiúil. Seo líon na sraitheanna nó na gcolún leictreon. Ná tabhair aird ar cholúin nach bhfuil iontu ach eilimintí crosáilte amach.Maidir le eribi, is iad na colúin eile 1, 2, 3, 4, 5 agus 6.
- Líon na bhfithiseán a chomhaireamh go suíomh an adaimh chun an chumraíocht a scríobh. Féach ar an tsiombail bloc a thaispeántar ar thaobh na láimhe deise den tábla peiriadach (í, p, d agus f) agus féach ar líon na gcolún a thaispeántar ag bun an tábla, beag beann ar línte trasnánacha idir bloic, roinn na colúin ina mbloic cholúin agus scríobh tá siad in ord ó bhun go barr. Déan neamhaird de bhloic cholún nach bhfuil iontu ach eilimintí crosáilte amach. Scríobh síos na bloic cholún ag tosú le huimhir an cholúin agus ansin an tsiombail bloc, mar seo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (i gcás eribi).
- Nóta: Tá an chumraíocht leictreon thuas do Er scríofa in ord ardaitheach líon na sraitheanna leictreon. Is féidir an chumraíocht seo a scríobh freisin in ord leictreoin a chur i bhfithiseáin. Lean na céimeanna ó bhun go barr in ionad colúin agus tú ag scríobh bloic cholún: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Líon na leictreon in aghaidh an fhithiseach a chomhaireamh. Comhairigh líon na leictreon nach dtrasnaítear i ngach bloccholún, sann leictreon amháin in aghaidh na heiliminte agus scríobh líon na leictreon in aice leis an tsiombail bloc do gach bloc-cholún, mar seo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Sa sampla seo, is é seo cumraíocht leictreon an eribi.
- Cumraíochtaí leictreon neamhghnácha a aithint. Tá ocht n-eisceacht déag coitianta i gcumraíocht leictreon adamh sa stát fuinnimh is ísle, ar a dtugtar an stát talún freisin. I gcomparáid le riail ghinearálta an ordáin, ní chlaonann siad ach ón dá shuíomh dheireanacha go trí leictreon. Sa chás seo, is í an chumraíocht iarbhír leictreon is cúis le staid fuinnimh níos ísle a bheith ag na leictreoin ná cumraíocht chaighdeánach an adaimh. Is iad na hadaimh neamhghnácha:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo. (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U. (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) agus Cm (..., 5f7, 6d1, 7s2).
Comhairle
- Nuair is ian é an t-adamh, ciallaíonn sé nach bhfuil líon na bprótón cothrom le líon na leictreon. Taispeántar muirear an adaimh ansin sa chúinne uachtarach ar dheis (de ghnáth) de shiombail na dúile. Mar sin beidh cumraíocht leictreon de 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p ag adamh antamóin le muirear +2. Tabhair faoi deara go n-athraítear 5p go 5p. Bí cúramach nuair a chríochnaíonn cumraíocht adamh atá neodrach go leictreach in aon fhithiseán seachas s agus p. Agus leictreoin bainte, ní féidir leat ach leictreoin a thógáil ó na fithiseáin faoisimh (s agus p orbitals). Mar sin má chríochnaíonn cumraíocht ag 4s 3d, agus má tá muirear +2 ag an adamh, athraíonn an chumraíocht go 4s 3d. Feicimid 3dtairiseach, ach ní bhaintear ach leictreoin san fhithiseach.
- Is iondúil go bhfilleann gach adamh ar staid chobhsaí, agus beidh go leor fithiseán s agus p (s2 agus p6) sa chumraíocht leictreon is cobhsaí. Tá an chumraíocht leictreon seo ag na gáis neamhchoitianta seo, agus is é sin an fáth gur annamh a bhíonn siad rannpháirteach in imoibrithe agus go bhfuil siad ar thaobh na láimhe deise den tábla peiriadach. Mar sin má thagann deireadh le cumraíocht ag 3p, ní gá dó ach dhá leictreon eile a chur leis chun a bheith seasmhach (theastódh níos mó fuinnimh chun sé leictreon a thabhairt ar shiúl, lena n-áirítear leictreoin an fhithiseáin, mar sin bheadh sé furasta ceithre leictreon a thabhairt ar shiúl. níos éasca). Má chríochnaíonn cumraíocht ag 4d, ní gá dó ach trí leictreon a thabhairt ar shiúl chun staid chobhsaí a bhaint amach. Mar an gcéanna, tá na fo-aicmí nua a fhaigheann leath de na leictreoin (s1, p3, d5 ..) níos cobhsaí, m.sh. p4 nó p2, ach beidh s2 agus p6 níos cobhsaí fós.
- Is féidir leat an chumraíocht leictreon faoisimh a úsáid freisin chun cumraíocht leictreon eiliminte a scríobh, arb é an fithiseán s agus p deireanach é. Dá bhrí sin, is é 5s 5p cumraíocht faoisimh adamh antamóin le haghaidh antamóin.
- Ní maith le Ions é sin toisc go bhfuil siad i bhfad níos marthanaí. Scipeáil an dá chéim thuas den alt seo agus oibrigh ar an mbealach céanna, ag brath ar an áit a dtosaíonn tú agus cé mhéad leictreon nó níos lú atá agat.
- Chun an uimhir adamhach a fháil óna cumraíocht leictreon, cuir na huimhreacha go léir a leanann na litreacha (í, p, d, agus f). Níl sé seo ceart ach más adamh neodrach é, más ian é ní féidir leat an modh seo a úsáid. Ina áit sin, ní mór duit líon na leictreon a thógann tú isteach a thabhairt nó a dhealú.
- Ní mór an uimhir a leanann an litir a scríobh sa chúinne uachtarach ar dheis, ní mór duit gan scríobh go mícheart agus an tástáil á déanamh agat.
- Tá dhá bhealach éagsúla ann le cumraíochtaí leictreon a scríobh. Is féidir leat scríobh in ord ardaitheach na sraithe leictreon, nó san ord ina gcuirtear na leictreoin i bhfithiseáin, mar a thaispeántar don adamh eribi.
- Tá cásanna ann nuair is gá leictreon a “bhrú suas”. Is é sin nuair nach bhfuil ach leictreon amháin ar iarraidh ag fithiseach go bhfuil leath nó na leictreoin go léir aige, ansin caithfidh tú leictreon a thógáil ón bhfithiseach s nó p is gaire chun é a aistriú isteach sa fhithiseach a bhfuil an leictreon sin de dhíth air.
- Ní féidir linn a rá go bhfaigheann “cobhsaíocht chodán fuinnimh” an fho-aicme leath de na leictreoin. Is ró-shimpliú é sin. Is é an chúis atá le leibhéal fuinnimh chobhsaí na fo-aicme nua a fhaigheann "leath líon na leictreon" ná nach bhfuil ach aon leictreon amháin ag gach fithiseach, agus mar sin déantar an t-eibleacht leictreon-leictreon a íoslaghdú.