Údar:
Helen Garcia
Dáta An Chruthaithe:
17 Mí Aibreáin 2021
An Dáta Nuashonraithe:
1 Iúil 2024
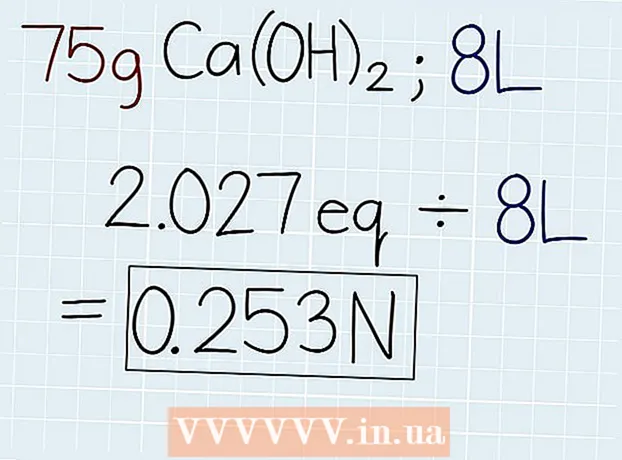
Ábhar
- Céimeanna
- Modh 1 de 2: Gnáthúlacht a Ríomh trí Pholaraíocht
- Modh 2 de 2: Normáltacht a ríomh in Aifreann Coibhéiseach
- Leideanna
- Céard atá ag teastáil uait
Léiríonn normáltacht tiúchan aigéad nó alcaile i dtuaslagán. Chun normáltacht tuaslagáin a fháil amach, is féidir polaraíocht agus mais choibhéiseach an mhóilín a úsáid sna ríomhanna. Má roghnaíonn tú polaraíocht a úsáid, bain úsáid as an bhfoirmle N = M (n), áit a bhfuil M polaraíocht agus n is é líon na móilíní hidrigine nó hiodrocsaíde. Má shocraíonn tú an mhais choibhéiseach a úsáid, úsáid an fhoirmle N = eq ÷ V, áit arb é eq líon na gcoibhéisí agus gurb é V toirt an tuaslagáin.
Céimeanna
Modh 1 de 2: Gnáthúlacht a Ríomh trí Pholaraíocht
 1 Cuir suas mais molar gach comhpháirt den tuaslagán. Faigh na heilimintí den fhoirmle cheimiceach ar an tábla peiriadach chun a mais adamhach a fháil, a fhreagraíonn don mhais mholar. Scríobh mais molar gach eilimint agus iolraigh í faoi líon na n-eilimintí sin. Cuir suas mais molar na gcomhpháirteanna go léir chun an mhais mholar iomlán a fháil.
1 Cuir suas mais molar gach comhpháirt den tuaslagán. Faigh na heilimintí den fhoirmle cheimiceach ar an tábla peiriadach chun a mais adamhach a fháil, a fhreagraíonn don mhais mholar. Scríobh mais molar gach eilimint agus iolraigh í faoi líon na n-eilimintí sin. Cuir suas mais molar na gcomhpháirteanna go léir chun an mhais mholar iomlán a fháil. - Mar shampla, más mian leat eolas a fháil ar mhais mholar aigéad sulfarach (H.2SO4), faigh amach mais mhaol hidrigin (1 g), sulfair (3 g) agus ocsaigin (16 g).
- Déan an mhais a iolrú faoi líon na gcomhpháirteanna sa chomhdhéanamh. Inár sampla, tá 2 adamh hidrigine agus 4 adamh ocsaigine ann. Is é mais iomlán molar hidrigine 2 x 1 g = 2 g. Is é mais molar ocsaigine sa tuaslagán seo 4 x 16 g = 64 g.
- Cuir na maiseanna molar go léir le chéile. Faigheann tú 2 g + 32 g + 64 g = 98 g / mol.
- Má tá polaraíocht an tuaslagáin atá á lorg agat ar eolas agat cheana féin, téigh go díreach chuig Céim 4.
 2 Roinn mais iarbhír an tuaslagáin leis an mais molar. Faigh amach meáchan iarbhír an tuaslagáin. Léireofar é ar an gcoimeádán leis an tuaslagán, nó sa tasc féin.Ansin déan mais an tuaslagáin a roinnt ar an mais iomlán molar a fuarthas níos luaithe. Is é an toradh a bheidh air sin líon na mól sa tuaslagán, agus ba chóir “caochÚn” a scríobh ina dhiaidh sin.
2 Roinn mais iarbhír an tuaslagáin leis an mais molar. Faigh amach meáchan iarbhír an tuaslagáin. Léireofar é ar an gcoimeádán leis an tuaslagán, nó sa tasc féin.Ansin déan mais an tuaslagáin a roinnt ar an mais iomlán molar a fuarthas níos luaithe. Is é an toradh a bheidh air sin líon na mól sa tuaslagán, agus ba chóir “caochÚn” a scríobh ina dhiaidh sin. - Mar shampla, má tá tú ag iarraidh normáltacht 100 g H a fháil amach2SO4tuaslagtha i 12 lítear de leacht, bain úsáid as an mhais iarbhír agus roinn ar molar. Mar thoradh air sin, gheobhaidh tú: 100 g ÷ 98 g / mol = 1.02 mol.
- Tá 1 caochÚn cothrom le 6.02 x 10 adamh nó móilín tuaslagáin.
 3 Roinn an toradh de réir mhéid an tuaslagáin i lítear chun an polaraíocht a fháil amach. Tóg líon na mól sa tuaslagán atá díreach ríofa agus déan é a roinnt ar mhéid iomlán an tuaslagáin atá le tomhas. Mar thoradh air sin, beidh a fhios agat an polaraíocht (M), ar féidir leat tiúchan an tuaslagáin a fháil amach.
3 Roinn an toradh de réir mhéid an tuaslagáin i lítear chun an polaraíocht a fháil amach. Tóg líon na mól sa tuaslagán atá díreach ríofa agus déan é a roinnt ar mhéid iomlán an tuaslagáin atá le tomhas. Mar thoradh air sin, beidh a fhios agat an polaraíocht (M), ar féidir leat tiúchan an tuaslagáin a fháil amach. - Bunaithe ar ár sampla, faighimid an fhoirmle seo a leanas: 1.02 mol ÷ 12 L = 0.085 M.
Comhairle: bí cinnte méid an tuaslagáin a thiontú go lítear, mura bhfuil sin déanta agat cheana. Seachas sin, gheobhaidh tú an freagra mícheart.
 4 Déan polaraíocht a iolrú faoi líon na móilíní hidrigine nó hiodrocsaíde. Féach ar an bhfoirmle cheimiceach chun líon na n-adamh hidrigine (H) a fháil amach in móilíní aigéad nó hiodrocsaíde in (OH) sa bhonn. Ansin iolraigh polaraíocht an tuaslagáin faoi líon na móilíní hidrigine nó hiodrocsaíde sa tuaslagán sin chun an gnáthchruinniú, nó normáltacht a fháil. Ag deireadh do fhreagra, scríobh an giorrúchán "N".
4 Déan polaraíocht a iolrú faoi líon na móilíní hidrigine nó hiodrocsaíde. Féach ar an bhfoirmle cheimiceach chun líon na n-adamh hidrigine (H) a fháil amach in móilíní aigéad nó hiodrocsaíde in (OH) sa bhonn. Ansin iolraigh polaraíocht an tuaslagáin faoi líon na móilíní hidrigine nó hiodrocsaíde sa tuaslagán sin chun an gnáthchruinniú, nó normáltacht a fháil. Ag deireadh do fhreagra, scríobh an giorrúchán "N". - Inár sampla, aigéad sulfarach (H.2SO4) 2 adamh hidrigine. Mar sin beidh an fhoirmle mar seo: 0.085 M x 2 = 0.17 N.
- I sampla eile, níl ach 1 mhóilín hiodrocsaíde ag hiodrocsaíd sóidiam (NaOH) le polaraíocht 2 M. Mar sin, beidh an fhoirmle mar seo a leanas: 2 M x 1 = 2 N.
Modh 2 de 2: Normáltacht a ríomh in Aifreann Coibhéiseach
 1 Faigh amach mais iomlán molar an tuaslagáin. Féach ar fhoirmle cheimiceach an tuaslagáin agus faigh gach eilimint ar an tábla peiriadach. Scríobh mais molar gach eilimint agus déan í a iolrú faoi líon na n-eilimintí sin san fhoirmle. Cuir na maiseanna molar go léir le chéile chun an mhais mholar iomlán a fháil i ngraim.
1 Faigh amach mais iomlán molar an tuaslagáin. Féach ar fhoirmle cheimiceach an tuaslagáin agus faigh gach eilimint ar an tábla peiriadach. Scríobh mais molar gach eilimint agus déan í a iolrú faoi líon na n-eilimintí sin san fhoirmle. Cuir na maiseanna molar go léir le chéile chun an mhais mholar iomlán a fháil i ngraim. - Mar shampla, más mian leat eolas a fháil ar mhais mholar Ca (OH)2, ansin faigh amach mais mhaol cailciam (40 g), ocsaigin (16 g) agus hidrigin (1 g).
- San fhoirmle tá 2 adamh ocsaigine agus hidrigine. Is é mais iomlán na hocsaigine: 2 x 16 g = 32 g Is é mais molar hidrigine: 2 x 1 g = 2 g.
- Cuir na maiseanna molar go léir le chéile chun 40 g + 32 g + 2 g = 74 g / mol a fháil.
 2 Roinn an mhais mholar le líon na móilíní hidrigine nó hiodrocsaíde. Faigh amach líon na n-adamh hidrigine (H) i móilíní aigéad nó hiodrocsaíde (OH) sa bhonn. Roinn an mhais mholar iomlán a fhaightear díreach faoi líon na n-adamh nó na móilíní chun meáchan 1 choibhéis a fháil, a bheidh cothrom le mais 1 mhóilín hidrigine nó hiodrocsaíde. Ag deireadh an fhreagra, scríobh an giorrúchán "G.-e." a chiallaíonn mais an choibhéis.
2 Roinn an mhais mholar le líon na móilíní hidrigine nó hiodrocsaíde. Faigh amach líon na n-adamh hidrigine (H) i móilíní aigéad nó hiodrocsaíde (OH) sa bhonn. Roinn an mhais mholar iomlán a fhaightear díreach faoi líon na n-adamh nó na móilíní chun meáchan 1 choibhéis a fháil, a bheidh cothrom le mais 1 mhóilín hidrigine nó hiodrocsaíde. Ag deireadh an fhreagra, scríobh an giorrúchán "G.-e." a chiallaíonn mais an choibhéis. - In ár sampla, Ca (OH)2 2 dhá mhóilín hidrigine, rud a chiallaíonn go mbeidh mais an choibhéis cothrom le 74 g / mol ÷ 2 = 37 G.-e.
 3 Roinn meáchan iarbhír an tuaslagáin leis an meáchan coibhéiseach. Tar éis duit mais an choibhéis a bheith ar eolas agat, déan í a roinnt ar mhais an tuaslagáin, a léirítear ar an gcoimeádán leis an tuaslagán nó leis an bhfadhb atá á réiteach. Is é an freagra a bheidh ar líon na gcoibhéisí sa tuaslagán ionas gur féidir leat an normáltacht a ríomh ansin. Ag deireadh an fhreagra, cuir an giorrúchán "e."
3 Roinn meáchan iarbhír an tuaslagáin leis an meáchan coibhéiseach. Tar éis duit mais an choibhéis a bheith ar eolas agat, déan í a roinnt ar mhais an tuaslagáin, a léirítear ar an gcoimeádán leis an tuaslagán nó leis an bhfadhb atá á réiteach. Is é an freagra a bheidh ar líon na gcoibhéisí sa tuaslagán ionas gur féidir leat an normáltacht a ríomh ansin. Ag deireadh an fhreagra, cuir an giorrúchán "e." - Más inár sampla 75 g Ca (OH)2, ansin beidh an fhoirmle mar seo a leanas: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Roinn líon na gcoibhéisí de réir mhéid an tuaslagáin i lítear. Faigh amach méid iomlán an tuaslagáin agus scríobh an freagra i lítear. Tóg líon na gcoibhéisí atá díreach faighte agus roinn de réir mhéid an tuaslagáin chun an normáltacht a fháil amach. Ag deireadh do fhreagra cuir giorrúchán "N".
4 Roinn líon na gcoibhéisí de réir mhéid an tuaslagáin i lítear. Faigh amach méid iomlán an tuaslagáin agus scríobh an freagra i lítear. Tóg líon na gcoibhéisí atá díreach faighte agus roinn de réir mhéid an tuaslagáin chun an normáltacht a fháil amach. Ag deireadh do fhreagra cuir giorrúchán "N". - Má tá 75 g Ca (OH) i dtuaslagán le toirt 8 lítear2, ansin roinn líon na gcoibhéisí leis an toirt ar an mbealach seo a leanas: 2.027 Oe. ÷ 8 l = 0.253 N.
Leideanna
- Úsáidtear gnáthchruinniú, nó normáltacht, go coitianta chun aigéid agus bunanna a thomhas. Más gá duit tiúchan tuaslagáin eile a chinneadh, déantar é seo de ghnáth tríd an polaraíocht a thomhas.
Céard atá ag teastáil uait
- Tábla tréimhsiúil
- Áireamhán