Údar:
Sara Rhodes
Dáta An Chruthaithe:
12 Feabhra 2021
An Dáta Nuashonraithe:
18 Meán Fómhair 2024

Ábhar
- Céimeanna
- Modh 1 de 3: Cad is pH ann
- Modh 2 de 3: Ríomh pH ó Thiúchan Aitheanta
- Modh 3 de 3: Tiúchan ó pH Aitheanta a Ríomh
- Leideanna
Sa saol laethúil, is gnách go dtuigtear pH mar scála a úsáidtear chun cur síos a dhéanamh ar neodracht nó, os a choinne sin, easpa neodracht substainte. I dtéarmaí eolaíochta, freagraíonn an luach pH do mhéid na n-ian i dtuaslagán ceimiceach. Má tá tú ag déanamh staidéir ar cheimic nó ar ábhair bhainteacha, b’fhéidir go mbeidh ort an leibhéal pH a ríomh bunaithe ar thiúchan na substaintí i dtuaslagán. Faightear an luach pH ag úsáid na foirmle seo a leanas: pH = -lg [H.3O].
Céimeanna
Modh 1 de 3: Cad is pH ann
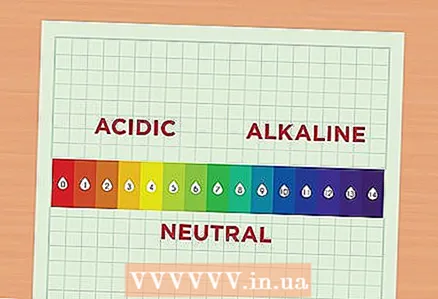 1 Faigh amach faoi pH. Freagraíonn an luach pH do thiúchan na n-ian hidrigine sa tuaslagán. Tugtar aigéadach ar thuaslagán le tiúchan méadaithe ian hidrigine, agus tugtar alcaileach ar thuaslagán le tiúchan laghdaithe na n-ian seo. Ainmnítear iain hidrigine go gairid mar H. Is féidir iad a léiriú freisin mar chuid de chomhdhúil, ansin tugtar hidriginiam orthu agus scríobhtar iad mar H30.
1 Faigh amach faoi pH. Freagraíonn an luach pH do thiúchan na n-ian hidrigine sa tuaslagán. Tugtar aigéadach ar thuaslagán le tiúchan méadaithe ian hidrigine, agus tugtar alcaileach ar thuaslagán le tiúchan laghdaithe na n-ian seo. Ainmnítear iain hidrigine go gairid mar H. Is féidir iad a léiriú freisin mar chuid de chomhdhúil, ansin tugtar hidriginiam orthu agus scríobhtar iad mar H30. - Léigh an scála pH. Raonta an scála pH ó 1 go 14. Dá ísle an líon, is aigéadach an tuaslagán. Os a choinne sin, is airde an luach, is mó alcaileach an tuaslagán. Mar shampla, is é 2 an pH atá ag sú oráiste toisc gur leacht measartha aigéadach é an sú seo. Tá pH de 12 ag bleach clóirín toisc go bhfuil go leor alcaile ann. I lár an scála tá tuaslagáin réasúnta neodracha, mar uisce, a bhfuil pH de 7 aige.
- Ciallaíonn difríocht 1 phointe idir dhá thuaslagán ar an scála pH go bhfuil aigéadacht éagsúil acu le fachtóir 10. Mar shampla, má ghlacann tú dhá thuaslagán le pH 6 agus 7, beidh aigéadacht an chéad tuaslagáin le pH 6 10 n-uaire níos airde ná aigéadacht an dara tuaslagáin le pH 7. Agus, mar shampla, tá aigéadacht tuaslagáin le pH 6 100 uair níos airde ná aigéadacht tuaslagáin le pH de 8.
 2 Cuir an chothromóid chun an pH a chinneadh i gcuimhne. Ríomhtar an scála pH ag baint úsáide as an logarithm deachúil dhiúltach. Freagraíonn logarithm deachúil dhiúltach do líon na nialais roimh cheann, lena n-áirítear slánuimhreacha nialasacha: mar shampla, is é 1 an logarithm deachúil diúltach de 0.1, is é 2, agus mar sin de. Seo a leanas an fhoirmle chun pH a fháil: pH = -lg [H.3O].
2 Cuir an chothromóid chun an pH a chinneadh i gcuimhne. Ríomhtar an scála pH ag baint úsáide as an logarithm deachúil dhiúltach. Freagraíonn logarithm deachúil dhiúltach do líon na nialais roimh cheann, lena n-áirítear slánuimhreacha nialasacha: mar shampla, is é 1 an logarithm deachúil diúltach de 0.1, is é 2, agus mar sin de. Seo a leanas an fhoirmle chun pH a fháil: pH = -lg [H.3O]. - Uaireanta scríobhtar an fhoirmle mar pH = -lg [H]. Is cuma má tá an chothromóid H.3O nó H, tá an dá rud comhionann.
- Ní gá a bheith in ann an logarithm deachúil a ríomh chun pH a fháil, ós rud é go bhfuil rogha ag beagnach gach áireamhán eolaíoch nó innealtóireachta é a ríomh.
 3 Foghlaim faoi thiúchan. Freagraíonn tiúchan substainte do líon na gcáithníní den tsubstaint seo atá sa tuaslagán. De ghnáth, léirítear an tiúchan i líon na mól in aghaidh an aonaid aonaid agus tugtar m / V, nó M. air i saotharlanna ceimiceacha, scríobhtar tiúchan na dtuaslagán ar na buidéil leo. Má tá fadhb cheimiceach á réiteach agat, is féidir an tiúchan a thabhairt sa riocht, nó caithfear í a fháil.
3 Foghlaim faoi thiúchan. Freagraíonn tiúchan substainte do líon na gcáithníní den tsubstaint seo atá sa tuaslagán. De ghnáth, léirítear an tiúchan i líon na mól in aghaidh an aonaid aonaid agus tugtar m / V, nó M. air i saotharlanna ceimiceacha, scríobhtar tiúchan na dtuaslagán ar na buidéil leo. Má tá fadhb cheimiceach á réiteach agat, is féidir an tiúchan a thabhairt sa riocht, nó caithfear í a fháil.
Modh 2 de 3: Ríomh pH ó Thiúchan Aitheanta
 1 Cuimhnigh an fhoirmle chun an pH a fháil. Seo an fhoirmle: pH = -lg [H.3O]. Déan cinnte go bhfuil tú eolach ar na heilimintí go léir atá sa fhoirmle seo. Féach cén luach a fhreagraíonn do thiúchan.
1 Cuimhnigh an fhoirmle chun an pH a fháil. Seo an fhoirmle: pH = -lg [H.3O]. Déan cinnte go bhfuil tú eolach ar na heilimintí go léir atá sa fhoirmle seo. Féach cén luach a fhreagraíonn do thiúchan. - Sa cheimic, ciallaíonn lúibíní cearnacha tiúchan rud éigin.Mar sin léann an fhoirmle chun pH a ríomh "Tá pH cothrom le logarithm diúltach an tiúchan ian hidriginiam."
 2 Faigh amach an tiúchan iarbhír. Léigh an ráiteas faidhbe go cúramach. Faigh tiúchan aigéad nó alcaile sna sonraí foinse. Scríobh síos an fhoirmle iomlán ar phíosa páipéir, agus cuir na luachanna aitheanta ann. Chun mearbhall a sheachaint, cuir aonaid tomhais in aice le huimhreacha in iúl i gcónaí.
2 Faigh amach an tiúchan iarbhír. Léigh an ráiteas faidhbe go cúramach. Faigh tiúchan aigéad nó alcaile sna sonraí foinse. Scríobh síos an fhoirmle iomlán ar phíosa páipéir, agus cuir na luachanna aitheanta ann. Chun mearbhall a sheachaint, cuir aonaid tomhais in aice le huimhreacha in iúl i gcónaí. - Mar shampla, más é 1.05 x 10 M an tiúchan, scríobh an fhoirmle chun pH a ríomh mar seo a leanas: pH = -lg [1.05 x 10 M]
 3 Ríomh an pH. Tá sé áisiúil áireamhán eolaíoch a úsáid chuige seo. Iontráil an comhartha lúide ar dtús tríd an gcnaipe "+/-" a bhrú. Ansin brúigh an cnaipe “log” a fhreagraíonn don logarithm deachúil (i mBéarla, tugtar logarithm deachúil mar log). Taispeánann an scáileán "-log". Ansin brúigh an lúibín ar chlé agus cuir isteach an tiúchan. Ná déan dearmad luach na céime a chur in iúl más gá. Ansin dún na lúibíní. Mar thoradh air sin, feicfidh tú “-log (1.05x10) ar an scáileán áireamháin. Cliceáil "=". Ba cheart go mbeadh luach pH de thart ar 4.98 agat.
3 Ríomh an pH. Tá sé áisiúil áireamhán eolaíoch a úsáid chuige seo. Iontráil an comhartha lúide ar dtús tríd an gcnaipe "+/-" a bhrú. Ansin brúigh an cnaipe “log” a fhreagraíonn don logarithm deachúil (i mBéarla, tugtar logarithm deachúil mar log). Taispeánann an scáileán "-log". Ansin brúigh an lúibín ar chlé agus cuir isteach an tiúchan. Ná déan dearmad luach na céime a chur in iúl más gá. Ansin dún na lúibíní. Mar thoradh air sin, feicfidh tú “-log (1.05x10) ar an scáileán áireamháin. Cliceáil "=". Ba cheart go mbeadh luach pH de thart ar 4.98 agat.
Modh 3 de 3: Tiúchan ó pH Aitheanta a Ríomh
 1 Faigh amach cad a thugtar agus cad ba mhaith leat a fháil. Scríobh síos an fhoirmle chun pH a ríomh. Ansin déan na luachanna aitheanta a ríomh trína luachanna a scríobh amach faoin bhfoirmle. Mar shampla, má tá a fhios agat gurb é 10.1 do pH, scríobh an uimhir sin faoi pH i do fhoirmle.
1 Faigh amach cad a thugtar agus cad ba mhaith leat a fháil. Scríobh síos an fhoirmle chun pH a ríomh. Ansin déan na luachanna aitheanta a ríomh trína luachanna a scríobh amach faoin bhfoirmle. Mar shampla, má tá a fhios agat gurb é 10.1 do pH, scríobh an uimhir sin faoi pH i do fhoirmle.  2 Tiontaigh an fhoirmle. Sa chás seo, beidh eolas uait ón gcúrsa ailgéabar scoile. Chun an tiúchan ó luach pH aitheanta a ríomh, is gá an fhoirmle a athrú ionas go seasfaidh an tiúchan ar leithligh ó gach taobh den chothromóid. Is é sin, is gá go bhfuil slonn ann ar thaobh amháin den chomhartha comhionann ina bhfuil an luach pH, agus ar an taobh eile - tiúchan an hidronium. Ar dtús, iolraigh an dá thaobh den chothromóid faoi -1. Ansin ardaigh 10 na cumhachtaí ar gach taobh den chomhionannas a leanann as.
2 Tiontaigh an fhoirmle. Sa chás seo, beidh eolas uait ón gcúrsa ailgéabar scoile. Chun an tiúchan ó luach pH aitheanta a ríomh, is gá an fhoirmle a athrú ionas go seasfaidh an tiúchan ar leithligh ó gach taobh den chothromóid. Is é sin, is gá go bhfuil slonn ann ar thaobh amháin den chomhartha comhionann ina bhfuil an luach pH, agus ar an taobh eile - tiúchan an hidronium. Ar dtús, iolraigh an dá thaobh den chothromóid faoi -1. Ansin ardaigh 10 na cumhachtaí ar gach taobh den chomhionannas a leanann as. - An comhionannas pH = -log a thiontú [H.3O], faighimid an fhoirmle + [H.3O] = 10, is é sin, tá an tiúchan ian deich go dtí an chumhacht -pH. Anois, in ionad pH, cuirimid luach aitheanta in ionad, inár gcás 10.1.
 3 Réitigh an chothromóid. Tá nós imeachta sonrach ann chun deichniúr a ardú go cumhacht sa áireamhán. An chéad chineál 10. Ansin brúigh an eochair easpónantóireachta. Iontráil comhartha lúide agus luach céime. Cliceáil "=".
3 Réitigh an chothromóid. Tá nós imeachta sonrach ann chun deichniúr a ardú go cumhacht sa áireamhán. An chéad chineál 10. Ansin brúigh an eochair easpónantóireachta. Iontráil comhartha lúide agus luach céime. Cliceáil "=". - In ár sampla, is é an pH 10.1. Diailigh "10" agus brúigh an eochair "EXP". Ansin brúigh "- / +", ag athrú an chomhartha. Faoi dheireadh, iontráil an luach pH "10.1" agus brúigh an eochair "=". Mar thoradh air sin, ba cheart duit 1e-100 a chríochnú. Ciallaíonn sé seo gurb é an tiúchan 1.00 x 10 M.
 4 Smaoinigh ar an bhfreagra a fuair tú. An bhfuil ciall fhisiciúil leis? Más é 10.1 an pH, ciallaíonn sé go bhfuil tiúchan an hidronium an-íseal agus go bhfuil tuaslagán alcaileach agat. Dá bhrí sin, freagraíonn an tiúchan an-íseal a fuarthas
4 Smaoinigh ar an bhfreagra a fuair tú. An bhfuil ciall fhisiciúil leis? Más é 10.1 an pH, ciallaíonn sé go bhfuil tiúchan an hidronium an-íseal agus go bhfuil tuaslagán alcaileach agat. Dá bhrí sin, freagraíonn an tiúchan an-íseal a fuarthas
Leideanna
- Má tá sé deacair do leibhéal pH a ríomh ar dtús, coinnigh i gcuimhne go bhfuil go leor foinsí ann chun níos mó a fhoghlaim faoin ábhar. Úsáid téacsleabhar ceimice nó iarr ar mhúinteoir cabhrú leat.